CYTOLOGIE
– NAUKA O BUŇKÁCH
Materiály slouží
ke studiu daného předmětu.
Jiné
použití konzultujte laskavě s autorem.
Kontakt
na učitele: ptacek@sci.muni.cz
Anglicko český slovník pro případnou potřebu při
studiu obrázků:
http://www.translator.cz/bin/translator
Obsah tématického oddílu
1.
1. CYTOLOGIE – I (stavba buněk)
1.1.
1.1.
Zrod cytologie
1.2.
1.2.
Dnešní definice buňky
1.3.
1.3.
nebuněčné formy v živé přírodě
1.4.
1.4.
Buněčné formy
1.4.1. 1.4.1. Prokaryota
(předjaderní buňky)
1.4.2. 1.4.2. Eukaryotické buňky
1.4.2.1. 1.4.2.1. Živočišné buňky
1.5.
1.5.
Struktura
živočišné buňky
a) Podle tradičního dělení
b) Podle výsledků elektronové mikroskopie
1.5.1.
1.5.1.
Buněčné obaly
1.5.1.1. 1.5.1.1. Cytoplazmatická membrána
1.5.1.2. 1.5.1.2. Průchod látek membránou
1.5.1.3. 1.5.1.3. Morfologická membrána
1.5.1.4. 1.5.1.4. Mezibuněčné hmoty
1.5.2.
1.5.2.
Buněčné jádro
1.5.3.
1.5.3.
Jadérko (nucleolus)
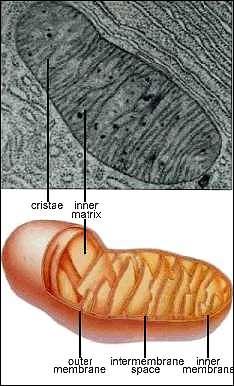
1.5.4. Mitochondrie
1.5.5. Endoplazmatické retikulum
(ergastoplazma)
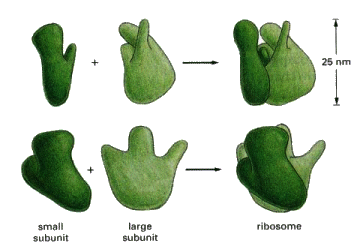
1.5.6. Ribozómy
1.5.7. Dělící tělísko (cytocentrum, centrozóm,
periplast)
1.5.8. Lysozómy
1.5.9. Golgiho síť (Golgiho aparát, endopegma)
1.5.10. Mikrotělíska
1.5.11. Cytoskelet
1.5.12. Buněčné inkluze (metaplazma)
1.5.13. 1.5.13. Peroxizómy
2. CYTOLOGIE – II (rozmnožování buněk)
2.1. AMITÓZA
2.2. Mitóza
2.2.1. Chromozómy
2.2.2. Průběh mitózy
2.2.2.1. Karyokinéze
I. Profáze
II. Matafáze
III. Anafáze
IV. Telofáze
2.2.2.2. Cytokinéze
2.2.3. Modifikace mitózy
2.2.4. Ovlivnění mitózy
2.3.
2.3.
Život
buňky
2.3.1. Buněčná
smrt - apoptóza
2.4. MEIÓZA -
dělení redukční (zrací)
2.4.1. První zrací dělení
2.4.1.1. Profáze
a) Leptotenne
b) Zygotenne
c) Pachytenne
d) Diplotenne
e) Diakineze
2.4.1.2. Metafáze 1. zracího dělení
2.4.1.3. Anafáze 1. zracího dělení
2.4.1.4. Telofáze 1. zracího dělení
2.4.2. Druhé zrací
dělení
2.4.3.
2.4.3.
Průběh meiózy
3.
3.
Struktura DNA a
přepis genetické informace
3.1.
3.1.
DNA – primární, sekundární a terciální
struktura
3.2.
3.2.
Mitochondriální DNA
3.3.
3.3.
Replikace
DNA
3.4.
3.4.
Přehled transkripce a translace
3.5.
3.5.
DNA -
RNA (transkripce)
3.6.
3.6.
RNA –
bílkoviny (translace)
3.7.
3.7.
Struktura ribozómů
1.1. Zrod
cytologie (URL 1)
byl podmíněn
objevem mikroskopu koncem 16. století.
Objev
mikroskopu: Holanďané J.a Z.
Jansenovi (1590, URL 2)
vybrousili první čočky a sestrojili mikroskop. Italové připisují objev
mikroskopu družině kolem Galilea Galileiho (1564 –1642, URL 3).
Ital Stelluti (1630) poprvé pozoroval objekty mikroskopem, Ital Marcelo
Malpighi (1628-1694) popsal struktury některých orgánů stejně jako Angličan
Grew (1641-1711).
Nejvýznamnějším průkopníkem mikroskopie byl Holanďan Antony
van Leeuwenhoek (1632-1723, URL 5).
Prováděl rozsáhlá pozorování prvoků, hub, bakterií a jiného biologického
materiálu. Za pomoci Regniera Graafa informoval Royal Society v Anglii o svých
objevech ve 120 obsáhlých dopisech. V roce 1677 objevil spermie a kapiláry
(odvolává se na Malpighiho), a v roce 1680 byl
zvolen členem Pařížské akademie věd. Objevil prvoky (1675) a bakterie
(1683). Měl mikroskop velmi dobré kvality. Regnier Graaf (1641-1673) byl lékař
(folikul ve vaječnících), člen anglické
Royal Society, introvert, který neovládal latinu. Po nocích pozoroval
vlasy, kůži, vlákna, prvoky a vše zakresloval.
Buňku poprvé popsal Angličan Robert Hooke (1635
–1703, URL
8). Zkoumal parafinové řezy rostlinného materiálu – např. korek, ve kterém
pozoroval mnoho komůrek (buňky). V práci
nazvané Micrographia (1665) zveřejnil pojednání o použití a výkonnosti jím
sestrojeného drobnohledu a shrnul všechny dosavadní poznatky.
Jádro s
jadérkem definoval Fontana
(1781) jako vejčitá tělíska se skvrnkou. Dutrochet (1824) objevil, že
těla živočichů jsou také z buněk (granula, zrnéčka). Dále pak se na rozvoji
cytologie podílela celá řada dalších badatelů včetně J.E. Purkyně (1787
– 1869, URL 4). Ten první
poukázal na skutečnost, že všechny rostlinné i živočišné tkáně se skládají
z buněk, a také jako první použil na přípravu preparátů mikrotom. Narodil
se v Libochovicích, studoval na UK v Praze fyziologii smyslové a nervové
činnosti. Působil jako lékař a profesor fyziologie ve Vratislavi a později
v Praze, kde také založil Fyziologický ústav. Na základě dřívějších
poznatků i svých vlastních pozorování vyslovil jako jeden z prvních
myšlenku tzv. buněčné teorie, podle které je buňka základní stavební jednotkou
všech organismů. Od Purkyněho pochází také název protoplazma (1937), označující
živou hmotu obsaženou v buňkách. Popsal několik typů (URL 9) nervových buněk,
které byly po něm pojmenovány. Purkyněho jev (změna poměrné světelnosti barev
při adaptaci oka na tmu).
Vlastní zrod cytologie spadá do první poloviny 19.
století. Mezi zakladatele cytologie patří především M. Schleiden (1804
–1882, URL
196) a T. Schwann (1810
–1882, URL 197), kteří
formulovali buněčnou teorii. Schwannův spis z r. 1839 vzbudil značnou
pozornost, a proto je buněčná teorie označována nejčastěji jako teorie
Schleiden-Schwannova. Tito autoři se však domnívali, že nové buňky vznikají
novotvořením z mezibuněčných hmot, které označovali jako cytoblastém. Na
rozdíl od Purkyněho nevěnovali pozornost buněčným obsahům. Louis Pasteur (1822-1895, URL 198)
kromě jiného prokázal, že kvašení nemusí být vázáno na živou nepoškozenou
buňku. Robert Koch (1843-1910, URL
199) založil obor bakteriologie, Ilja Mečnikov (1845-1916, URL
200) začal studovat imunitu, Paul Ehrlich (1854-1915, URL
201) položil na vědecký základ chemoterapii.
Botanik M. Schleiden
v čas. Beiträge zur Phytogenesis definuje buňku a vytváří buněčnou
teorii: těla rostlin nejsou celistvá, ale skládají se z buněk. Setkává se s
Theodorem Schwannem, který vydává dílo o živočišné buňce. Věřili v novotvoření
z cytoblastému mezi buňkami.
Nägeli (1844) - buněčné jádro existuje nejen u
rostlin, ale i hub a řas. Rovněž pozoroval, ale nepochopil mitózu. W.
Hoffmeister podrobně popsal nepřímé
dělení buněk.
Němec Virchow (1821 –1902, URL
202) první poukázal na skutečnost, že každá buňka vzniká jen rozdělením již
existující buňky („Omnis cellula ex cellulae“). Počátky buněčné struktury a
života vůbec viděl v tvůrčím aktu Boha.
Max
Schultze objevil (1861), že buňky všech
organismů jsou složeny z protoplazmy a obsahují jádro.
Na tuto situaci navazuje rozvoj cytologie v souladu s
technickými možnostmi - zdokonalování optiky, mikrotomů a metod studia živé
hmoty. Až do objevu elektronového mikroskopu však zůstalo mnoho nejasného při
pozorování detailnějších struktur.
Další český cytolog F. Vejdovský (1849 –1939, URL 203),
profesor zoologie v Praze, první popsal centrozóm a periplast
(1886). Studoval struktury chromozómů. V r. 1835 se mu podařilo pozorovat
mitózu, nepochopil však její význam.
Mezitím se objevila teorie abiogeneze: vznik života z
neživé hmoty - Oparin (1894-1980), J.B.S. Haldane (1892 –1964, URL 204).
Oparin byl ruský biochemik, který současně
s Američanem Haldanem vytvořil teorii o vzniku života na základě
chemických a fyzikálních procesů. Byl silně ovlivněn Darvinovou evoluční
teorií. Podle jeho teorie život vznikl v podstatě náhodou, vývojem od
jednoduchých až po komplexní organické sloučeniny, schopné vlastní duplikace.
Mezi nejvýznamnější práce
minulého století, zakládající možnosti rozvoje moderní biologie ve století
dvacátém, patří práce Darwinovy (1809 –1882, URL 205), vysvětlující
mechanismus evoluce, a práce Gregora Mendela (1822 –1884, URL 206), objasňující
principy dědění vlastností. Jinak se však biologové v minulém století a ještě i
v počátcích tohoto století zaměřovali především na popis organismů a buněk a na
jejich systematické třídění.
Dvacáté století je ovšem všeobecně považováno za
století vědy a technického pokroku. První polovině tohoto století dominovaly
fyzika a chemie, ale druhá polovina je charakterizována rychlým rozvojem
biologie. Ten byl zprvu založen zejména na aplikaci metod chemie na výzkum pochodů
v živém organismu. Důležitý je posun od popisného přístupu
k dynamické biochemii a přenesení Darwinovy evoluční teorie i Mendelových
zákonů dědičnosti na molekulární úroveň.
Po objevu elektronového
mikroskopu (E. Ruska a M. Knoll,
1932, URL
207) nastal další rozvoj cytologie.
Byla objevena celá řada tzv. submikroskopických
struktur, které jsou součásti komplexu zvaného buňka.
|
|
Optimální zvětšení |
Maximální rozlišovací schopnost |
|
Lidské oko |
|
0,1 – 2 mm |
|
Optický mikroskop |
20 - 2000 x |
do 100 nm |
|
Elektronový mikroskop |
1 000 – 250 000 x |
0,5 nm |
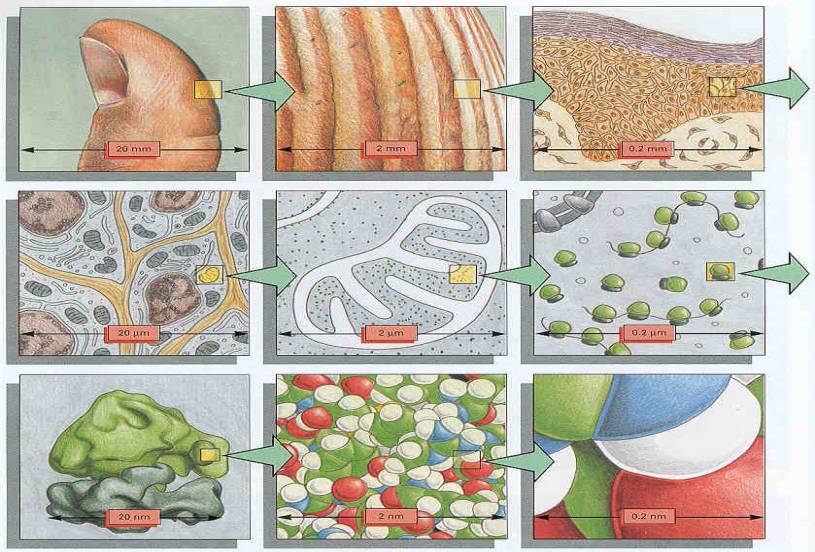 Názorná
stupnice zvětšení:
Názorná
stupnice zvětšení:
|
Světelný mikroskop:> 0,2 μm -
-
konvenční -
-
fázový kontrast -
-
interferenční kontrast -
-
fluorescence -
-
konfokální laserový skenovací |
Elektronový mikroskop: :> 0,2 nm -
-
transmisní -
-
skenovací skenovací |
Nelze opomenout důležité
práce Otto Warburga (1883 -1970), Hanse Krebse (1900 -1981) a
dalších, kteří položili základ současné biochemie. Zejména Krebsova koncepce
biochemických cyklů reakcí, v nichž se tvoří a spotřebovává energie a jíž
se organismy zbavují jedovatých zplodin metabolismu, vytvořila základ pro
pochopení toho, jak pracuje buňka.
Snad nejvýznamějším posunem
v poválečné biologii byl vznik oboru molekulární biologie. Mnozí
ztotožňují vznik molekulární biologie s objasněním struktury deoxyribonukleové
kyseliny (DNA) a s funkční implikací této struktury. Vskutku, až do práce Jamese
D. Watsona a Francise Cricka z počátku padesátých let nebyla úloha DNA
v uchovávání a přenosu dědičné informace všeobecně uznávána. Pokusy
Averyho a Oswalda s bakteriemi v třicátých a čtyřicátých letech sice
naznačovaly, že by DNA tuto úlohu mohla plnit, ale protože chyběl jakýkoliv
náznak možného mechanismu, nebyla tato interpretace všeobecně přijímána.
V té době se za základ
života považovaly proteiny (bílkoviny). Vědělo se, že enzymy, umožňující
chemické reakce v buňce, jsou proteinové povahy, a proto se mnoho úsilí
věnovalo, a stále ještě věnuje, studiu proteinů. Vznikl obor enzymologie.
Vlastnosti enzymů jsou natolik různorodé a jejich funkce natolik udivující, že
se jaksi bez důkazu a bližšího vysvětlení předpokládalo, že to jsou proteiny,
které zprostředkovávají, zatím neznámým mechanismem, dědění vlastností.
Strukturní biologie,
založená v Cambridgi, však tvoří jen jednu větev molekulární biologie. Za
druhé světové války a hned po válce studovali někteří fyzici v USA
pomnožování bakteriálních virů (bakteriofágů). Byli to zejména Max Delbrück
(URL
208) a Salvador Luria, kteří si uvědomili výhody experimentálního modelu
bakteriálních virů. Tyto výhody spočívají v tom, že v krátkém čase
(řádově desítky minut) lze získat početné populace virů, tedy nové generace
organismů (či alespoň biologických objektů, které mají mnohé vlastnosti
organismů). Na tomto modelu pak konečně bylo nade vší pochybnost prokázáno, že
nositelem dědičné informace je nukleová kyselina. A nejen to. Studiem těchto
poměrně jednoduchých systémů se podařilo definovat a prostudovat do značných
podrobností molekulární podstatu mnoha základních pochodů při uchovávání a
přenosu dědičné informace. Vznikl obor molekulární genetiky. Současná
molekulární biologie je syntézou těchto dvou směrů, tedy strukturní biologie a
molekulární genetiky. A mimořádně plodná je další syntéza, a sice výsledků
molekulární biologie a studia buněk a celých organismů: daří se porozumět
funkcím buněk a organismů v termínech molekul.
V šedesátých letech se biochemickými a
molekulárně biologickými metodami podařilo nahromadit významné množství
informací o molekulární podstatě života, o přenosu genetické informace z rodičů
na potomstvo, o mechanismech regulujících látkovou výměnu a o chemických
reakcích tvořících podstatu životních pochodů v buňkách.
V roce 1966 byl rozluštěn genetický kód, na němž je
založen překlad dědičné informace uložené v DNA do funkčních molekul
proteinů. K velmi důležitým objevům došlo ve Francii v laboratořích Francoise
Jacoba, Jacquese Monoda a André Lwoffa. Zejména Monod (URL
209) ovlivnil celou generaci biologů svou knihou “Náhoda a nutnost” (i
když dnes nejsou Monodovy myšlenky všeobecně přijímány). Tito vědci položili
základ k řešení snad nejdůležitějšího problému současné biologie, kterým je
podstata diferenciace buněk do orgánů a tkání a vývoj organismů. Studovali
molekulární mechanismy regulací a jejich práce, provedené na bakteriích a
bakteriofágách, tvoří pevný základ dnešního pohledu na podstatu diferenciace.
Velmi účinné metody pro studium mechanismů řídících
životní pochody vznikly na základě Watsonem, Crickem a Franklinovou (URL
157) objevené vlastnosti DNA, a sice na tom, že se molekuly DNA skládají ze
dvou vláken obtočených kolem sebe do známé dvoušroubovice. Spojení obou vláken
DNA je velmi specifické a přesné a na základě této přesnosti je možné zjišťovat
a analyzovat přítomnost i malých specifických úseků DNA ve velmi heterogenních
směsích molekul DNA. Při studiu DNA vyšších organismů těmito metodami se v
sedmdesátých letech ukázalo, že genetická informace je v buňkách těchto
vyšších organismů uspořádána principiálně jinak než genetická informace
bakterií a virů. Následovala řada objevů, které dokazovaly, že i mechanismy,
jimiž je dědičnost uchovávána a využívána u vyšších organismů, jsou daleko
složitější než jak ukazovala zjednodušená představa získaná studiem bakterií a
bakteriofágů.
Buňka (URL 120) je okrsek protoplazmy
ohraničený na povrchu jemnou cytoplazmatickou membránou a od vnějších vlivů
chráněný zpravidla silnější morfologickou blánou buněčnou (buněčnou stěnou).
Vlastní protoplazma je rozlišena na jaderný obsah (karyoplazmu) a ostatní živou
hmotu (základní cytoplazma). V cytoplazmě nacházíme různé struktury.
Jako celek je buňka
základní a současně minimální morfologickou a funkční jednotkou živé
hmoty, která je schopná samostatné existence. Pojem minimální zde znamená, že
není dělitelná na jednodušší složky, které by vykazovaly všechny základní znaky
živé soustavy, a současně i to, že všechny složitější živé soustavy obsahují
buňku jako strukturální a funkční subsystém.
1.3. NEBUNĚČNÉ FORMY V ŽIVÉ PŘÍRODĚ
Přechod mezi makromolekulami a buňkou tvoří nebuněčné
organismy: priony, viroidy a viry.
Konají jen některé ze základních funkcí živých organismů. Rozmnožují se
s využitím biochemie hostitele. Jsou to parazité, jejichž základ tvoří
bílkoviny (priony) nebo nukleové kyseliny (ostatní). Nebuněčné formy života
jsou považovány za degenerované organismy. Musely vzniknout později než buňky
hostitele, protože jsou vázány na
jejich metabolismus.
Priony (URL
210, URL
211) jsou bílkovinné částice parazitující na nervových buňkách savců
(Jacobova nemoc u člověka). Je to v podstatě složitý specifický protein, který
je netypicky zformován - a právě toto zvláštní zformování dělá z prionů to, čím
jsou. Když se prion dostane do kontaktu s normálním proteinem v mozku, nezničí
ho, ale zatím z neznámých důvodů protein začne napodobovat prion a formovat se
podle něj. Stane se vlastně prionem. Postupně se většina proteinů v mozku změní
na priony, a mozek se tak mění v houbovitou hmotu. Není dosud známo, proč tělo
nemůže priony na rozdíl o běžných proteinů štěpit. Mimo to jsou priony těžko
zničitelné. Nepodaří se je všechny zlikvidovat ani při teplotě vyšší než 135 °C. Dokonce se některé priony
udržely i v mase, které bylo po celou hodinu vystaveno teplotě 360 °C. Stejně je tomu s pohřbíváním
krav. Po třech letech sice těla krav zetlela, ale priony jsou stále na místě.
Do lidského těla se priony dostanou pravděpodobně nakaženou potravou, tedy
trávicím ústrojím. Po síti nervových buněk pak putují do mozku.
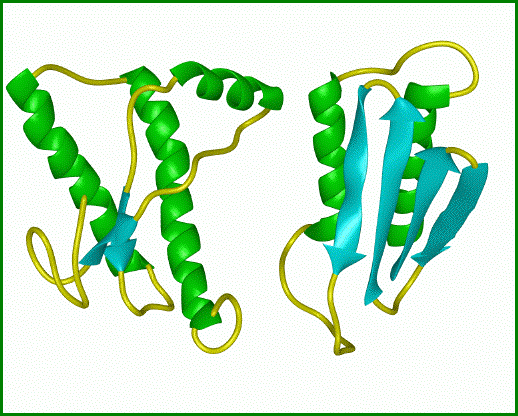
Obrázek: Srovnání
normálního proteinu s patogenním prionem. Normální protein (vlevo)
obsahuje aminokyseliny uspořádané v α-šroubovici. Infekční prion
(vpravo) vzniká, když se oblasti aminokyselinového řetězce se strukturou α-šroubovice
rozvinou a vytvoří v proteinu β-konformaci. Převzato z www.
Gen pro syntézu těchto bílkovin je asi běžně v genomu
savčích buněk. Aktivita nastává jen za určitých podmínek. Podařilo se izolovat
prionový gen, jehož produkt byl schopen vyvolat onemocnění u pokusných zvířat.
Při bližším zkoumání zjistilo, že existují dva druhy prionů. První druh bývá
označován jako PrPc (celulární), který se běžně vyskytuje ve všech organismech
a nevykazuje žádné známky infekčnosti. Jeho funkce v organismu je dosud
neznámá. Naproti tomu PrPsc (scrapie) se vyznačuje bodovou mutací na jedné z
aminokyselin. Tento druh se ještě dále dělí na 3 poddruhy dle bodové mutace, se
kterou souvisejí i druhy chorob, které způsobuje. K přeměně PrPc na PrPsc
dochází pravděpodobně mutací v jedné z buněk, kdy vzniká PrPsc, tento se
následně naváže na PrPc a dosud neznámým způsobem jej přemění na PrPsc. Dochází
tak k řetězovité reakci ("dominový účinek"). Priony se nahromadí v
mimobuněčném prostoru, kde se shlukují v masu (vytvoří tzv. amyloidní plak).
Krátký průběh nemoci s dlouhou inkubační dobou svědčí o tom, že se priony tvoří
exponenciální řadou.
Vlevo prion způsobující onemocnění mozku, vpravo normální
protein, běžně se v mozku vyskytující. Největší rozdíl je v oblasti
hlavní α-šroubovice, znázorněné žlutočerveně. U patogenního prionu
šroubovice po 5 otáčkách končí, zatímco v normálním proteinu má 7 otáček.
Srovnání sekvencí ukazuje jejich podobnost, což podporuje teorii o tom, že tyto
choroby způsobuje špatná prostorová struktura molekuly proteinu. Převzato
z www.
Viroidy (URL
212) jsou nejmenší známé patogeny. Tvoří je jednovláknová kruhová molekula
RNA (kolem 300 nukleotidů) v hostitelské buňce. Tato molekula se
v určitých místech stáčí do dvouřetězcových oblastí. Toto vnitřní párování
bazí jim dává v nativním stavu jejich charakteristický tvar
tyčinky.Viroidy nemají bílkovinný obal. Podle obecně přijímaného modelu
struktury se částice viroidu skládá z několika oblastí:
1 Centrální
část, která vykazuje vysokou hladinu homologie mezi viroidy téže taxonomické
skupiny.
2
2
Patogenní oblast, vykazující homologii
mezi viroidy s podobným rozsahem hostitelů. Mutace v této oblasti
mohou ovlivnit infekčnost viroidu a
symptomy napadení.
3
3
Proměnná oblast s vysokou sekvenční
variabilitou,
4
4
Dvě koncové oblasti.
(URL 24)
Pomocí RNA
polymerázy se syntetizuje mnoho kopií. Infikované buňky vykazují změny
v cytoplazmatické membráně, jadércích a chloroplastech. Organismy vykazují
defekty v morfogenezi, případně dochází ke smrti hostitele. RNA viroidů
kóduje jediný protein, tzv. delta antigen. Jsou patogenní pro rostliny
(brambory, okurky, citrony). Šíří se mechanickou cestou mezi rostlinami téže
populace. Jejich přenos hmyzem nebyl dosud prokázán. V poslední době byly však popsány i u onemocněné lidí
hepatitidou D (v tomto případě je viroid uzavřen v kapsuli viru hepatitidy
B)
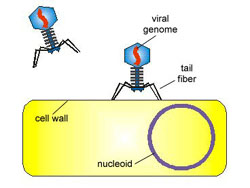
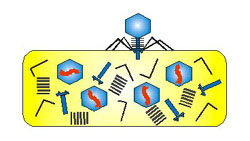
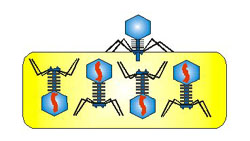
Viry a
bakteriofágy (URL 213)
Jsou to nebuněčné organismy, schopné rozmnožování
pouze v hostitelských buňkách (tzv. nitrobuněční molekulární parazité).
Nemají vlastní aparát pro syntézu bílkovin, ribozómy a t-RNA, ani vlastní
metabolický aparát. Je to vlastně infekční nukleová kyselina, jejíž životní
projevy jsou úzce spjaty s hostitelskou buňkou. Viry bakterií se nazývají
bakteriofágy. Jednotlivá částice viru, schopná infikovat buňku, se nazývá
virion. Jeho velikost se pohybuje v rozmezí 15-390 nm. Vnější vrstvu tvoří
bílkovinný obal (kapsid), s geometricky pravidelnou strukturou (složený z
42-252 kapsomer). Uvnitř se nachází nukleová kyselina - RNA nebo DNA. Podle
toho rozlišujeme RNA viry (většina rostlinných virů) a DNA viry (většina
živočišných virů). Na rozdíl od vyšších organismů se v organismu viru nikdy
nevyskytují obě tyto kyseliny současně. DNA viry i RNA viry vytvářejí v
napadené buňce kopie svých nukleových kyselin i bílkovin. Receptorem je
specifická bílkovina buňky v membráně. Specifické virové receptory se kromě
membrány hostitelské buňky nacházejí i ve stěně viru. Virus napadne jen takovou
buňku, která má na svém povrchu bílkovinu sloužící jako receptor. Některé viry
nejsou příliš specifické, každopádně ale není známo, že by některý dokázal
současně napadat prokaryotické i eukaryotické buňky.
Některé
viriony mají uvnitř kapsidů kromě nukleové kyseliny ještě jeden nebo více
enzymů, potřebných k zahájení své reprodukce uvnitř hostitelské buňky. Někdy se
kolem kapsidu nachází ještě membránový obal tvořený bílkovinami a fosfolipidy
(pokud má virus kolem kapsidy ještě další ochranný obal, zpravidla ho získal z
biomembrány hostitelské buňky, kterou se obalil, když buňku opouštěl.). Virové
bílkoviny jsou vždy specifické a udělují viru antigenitu.
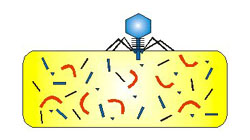
Základní životní cyklus viru:
l) Jako klidová forma mimo hostitelskou buňku v
neživém prostředí.
2) Infikuje hostitelskou buňku a rozmnožuje se v ní.
3) Jako virion je po rozpadu buňky uvolňován do
prostředí.
Průběh
virové infekce:
1)
1)
Přilnutí viru na povrchu buňky: Aby se
virus mohl přichytit, musí mít hostitelská buňka na svém povrchu specifické
receptory (buňka je citlivá na virus). Nositelem specifity je membránový obal
(u virů bez obalu kapsid). Některé viry, převážně rostlinné, pronikají do buňky
i nespecificky, mechanicky. Kromě citlivosti k viru rozlišujeme ještě
permisivitu buňky, tj. schopnost buňky uskutečnit genetický program nukleové
kyseliny viru poté, kdy vnikla do buňky.
2)
2)
Vniknutí viru do buňky - buď vniká jen
nukleová kyselina (u bakterií), nebo celý virus (u živočišných buněk). V tomto
případě je membránový obal a kapsid
rozložen hydrolytickými enzymy buňky.
3)
3)
Podle genetických informací obsažených v
nukleové kyselině viru se v hostitelské buňce začnou syntetizovat enzymy, z
nichž jeden způsobí rozpad chromozomů hostitelské buňky. Virová nukleová
kyselina se replikuje 100x až 1000x. Okolo každé nukleové kyseliny se vytvoří
ochranný kapsid. Hostitelská buňka praskne (lyzuje) a viriony se uvolní do
prostředí.
Nukleové kyseliny viru se někdy včleňují do nukleové
kyseliny (chromozomu) hostitelské buňky a stanou se její součástí.Tento tzv.
virový chromozom je předáván dceřinným buňkám jako tzv. provirus. Za určitých
podmínek (chemických, fyzikálních) může provirus udělit hostitelské buňce nové
vlastnosti - nejčastěji se buňka stává buňkou nádorovou.
|
|
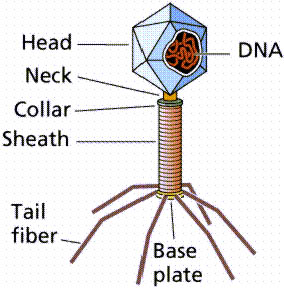
Bakteriofág se váže na buněčnou stěnu bakterie. |
|
|
Bakteriofág
injikuje svůj genetický materiál do bakterie |
|
|
Replikace
genomu bakteriofága. |
|
|
Pokračuje produkce komponent bakteriofága a enzymů. |
|
|
Z
komponent se vytváří fágové částice |
|
|
Enzymy bakteriofága rozruší bakteriální stěnu a obsah se uvolní |
|
Copyright Dr. Gary Kaiser. S laskavým
svolením. |
|
Příklady virových
onemocnění
U rostlin: mozaiková onemocnění tabáku, brambor,
rajčat.
U zvířat: kulhavka a slintavka hovězího dobytka,
vzteklina, myxomatoza králíků, mor u drůbeže.
U člověka: dětská obrna, rýma, chřipka, spalničky,
klíšťová encefalitida, opar, infekční žloutenka.
Klasifikace
virů (URL 176)
V současné době je známo několik desítek tisíc
druhů viru. Spektrum jejich hostitelů je velmi široké. Jejich morfologická
stavba je však celkem stejnorodá. Proto se jejich základní klasifikace opírá o
jejich hostitelské spektrum. V takto pojatém systému rozlišujeme čtyři
základní skupiny virů: prokaryotické viry, rostlinné viry, mykoviry a živočišné
viry.
Prokaryotické viry
Jsou to viry baktérií (bakteriofágy) a sinic (cyanofágy).
Bakteriofág se na rozdíl od virů
skládá ze tří složek: hlavičky, bičíku a bičíkových vláken. Rozeznáváme vnitřní
hlavovou část s nukleovou kyselinou (RNA-fágy, DNA-fágy), a obal tvořený
bílkovinami. Bakteriofágy jsou schopny se vázat pouze na specifické receptory
bakteriálnich buněk a pouze v nich realizovat svůj reprodukční cyklus. Jsou
důležitým činitelem v udržování ekologické rovnováhy bakteriálnich
společenstev. Určité uplatnění nalézají bakteriofágy v medicíně, kde
slouží k prevenci i léčbě některých
bakteriálních onemocnění.
Cyanofágy jsou velmi podobné bakteriofágům. Jejich viriony mají ikosahedrickou
hlavičku a krátký helikálni bičík. V hlavičce je uložena vždy DNA.
Převzato z URL 112,
viz též URL
190 a URL
191 (čb.).
Rostlinné viry
Mají
většinou helikální strukturu virionu, což je dáno tím, že jsou to převážně RNA-viry.
Jednotlivé druhy virů způsobují různé choroby rostlin. Příznaky napadení
rostliny bývají velmi podobné: zpomalení růstu, svíjení a deformace listů,
odbarvování a projasňování cév a často chlorotické až nekrotické skvrny, dobře
patrné na pozadí zdravého pletiva. Rostlinné viry jsou nejčastěji přenášeny
hmyzem, parazitickými hlísty a houbami.
Mykoviry
Jsou to viry napadající buňky
hub. Nejznámější jsou mykoviry plísní a kvasinek. Vyskytují se jak ve formě
RNA-mykovirů, tak i DNA mykovirů. Je pro ně typický spíše latentní než lytický
průběh infekce.
Živočišné viry
Jsou nejlépe prostudovanou skupinou virů, protože mnohé z nich jsou
původci vážných onemocnění člověka. Přenášejí se vzduchem (kapénková infekce),
hmyzem, potravinami, vodou, přímým kontaktem s kůží infikovaného, tělními
sekrety (moč, sperma, sliny) a krví.
Dělíme je do čtyř hlavních skupin:
1. Neobalené DNA-viry. Mají ikosahedrickou strukturu kapsidu, ve
kterém je jednořetězcová DNA. Napadají hmyz, ptáky i savce včetně člověka. Patří
mezi ně následující čeledi virů:
a) a)
Papovaviry (Papovaviridae) jsou onkogenní viry savců. U člověka je z této
skupiny znám virus bradavic.
b) b)
Adenoviry (Adenoviridae) jsou viry infikující dýchací soustavu ptáků a savců.
Některé z nich mohou být onkogenní.
c) c)
Iridoviry (Iridoviridae) jsou typické hmyzí viry,
které nejsou přenosné na člověka.
2. Obalené DNA-viry.
Jsou to viry, které mají na povrchu
bílkovinného kapsidu fosfolipidovou membránu.
a) a)
Herpesviry (Herpesviridae) jsou velmi pestou a
početnou čeledí virů. Působí infekční opary různých druhů ptáků a savců včetně
člověka. Některé z nich jsou onkogenní.
b) b)
Bakuloviry (Baculoviridae) jsou výhradně hmyzí viry.
c) c)
Poxviry (Poxviridae) tvoří velmi početnou čeleď virů. Patří mezi ně mnoho
virů patogenních pro hmyz, ptáky a savce (viry kravských neštovic, myxomatózy a
fibromatózy králíků).
3. Neobalené RNA-viry mají
na svém povrchu pouze bílkovinný kapsid, obsahují jednořetězcovou RNA. Patří
k nim
a)
a) Reoviry (Reoviridae). Jde o skupinu virů známých i u rostlin, které
infikují široké spektrum živočišných hostitelů. Většina infekcí probihá bez
příznaků. Některé druhy však mohou způsobovat střevní průjmovitá onemocnění
4. Obalené RNA-viry mají na povrchu kapsidu kromě bílkovinných
molekul ještě i fosfolipidovou membránu hostitelské buňky.
a)
a) Paramyxoviry (Paramyxoviridae). Do této čeledi patří celá
řada původců onemocnění člověka (viry spalniček, zarděnek a příušnic) a řady
savčích a ptačích druhů.
b) b) Rabdoviry (Rhabdoviridae) zahrnují řadu savčích,
hmyzích, ale i rostlinných virů. Z virů nebezpečných pro člověka
k nim patří virus vztekliny.
c) c) Bunyaviry (Bunyaviridae) jsou viry přenášené
členovci na savce, u kterých vyvolávají záněty mozku (encefalitidu).
d) d) Togaviry (Togaviridae). Zástupci této čeledi jsou
původci některých závažných onemocnění člověka, např. žluté zimnice nebo
klíšťové encefalitidy. Jsou to virózy přenášené členovci.
e) e) Retroviry (Retroviridae) tvoří rozsáhlou čeleď virů,
které mohou způsobovat vznik zhoubných nádorů (sarkomy, lymfomy či leukémie). Jsou to viry ptáků a savců. Jejich nositelem genetické informace je
jednořetězcová RNA; zvláštní enzym - reversní transkriptáza - podle ní
syntetizuje komplementární DNA, která se vřazuje do DNA hostitelské
(infikované) buňky. Do této čeledi pak
patří v poslední době často diskutovaný virus HIV (URL 213)
virus HIV
1.4.
BUNĚČNÉ FORMY
Organismy: Podle složitosti je dělíme na
a)
jednobuněčné
b) jednobuněčné v koloniích (stejné buňky)
c) mnohobuněčné (diferenciace buněk)
Rozlišujeme dva základní typy (URL
214) strukturálně odlišných buněk, buňky prokaryotní (prokaryotické) a
eukaryotní (eukaryotické). Základem tohoto dělení je odlišná struktura jádra.
Eukaryotická buňka se vyznačuje tím, že je poměrně veliká, složitá, má dobře
rozlišené jádro oddělené membránou a v cytoplazmě řadu organel nejrůznějších
tvarů a funkcí. Prokaryotická buňka je malá, jednoduchá, bez ohraničeného jádra
a rozlišených organel. Do říše prokaryot byly zařazeny bakterie a sinice,
eukaryota pak zahrnují vše ostatní a jsou rozdělena na čtyři říše.
V 60. letech se začal prosazovat názor, že
chloroplasty a mitochondrie jsou původně prokaryotické buňky, které byly kdysi
dávno v minulosti pozřeny a ve svém hostiteli tak zdomácněly, že si dnes život
jeden bez druhého nedovedou představit. Tato endosymbiotická hypotéza je dnes
dobře doložena a všeobecně uznávána. Mitochondrie a chloroplasty mají vlastní,
byť degenerovanou DNA a proteosyntetický aparát, jsou nápadně příbuzné některým
současným bakteriálním druhům a jsou obaleny dvěma cytoplazmatickými mebránami
rozdílného charakteru: vnitřní membrána je spíše bakteriální, vnější membrána
je hostitelova.
1.4.1. Prokaryota (předjaderní buňky) (URL 215 )
Vznikly před 3-3.5 miliardami let, jak dokazují africké usazeniny. Mají
drobnou velikost (1-2 μm) a rozmanitý tvar. Jejich stavba je jednoduchá.
Mají jen jeden systém buněčných membrán (plazmolema). Jaderný materiál není
oddělen od základní cytoplazmy.
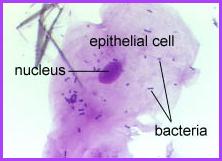
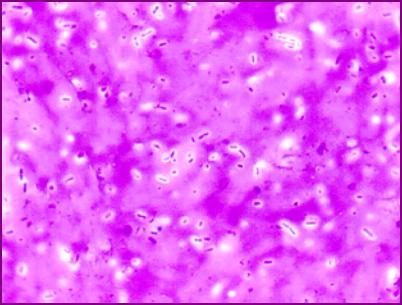
Bakterie na epitelové buňce v lidských ústech.
Bakterie jsou malé tmavé body a čárky. Oválná tmavá oblast uprostřed je jádro
epitelové buňky.
Copyright Dr. Bary Kaiser. S laskavým svolením.
Cytoplazmatická membrána vytváří vchlípením
enzymatické systémy (výběžky), mesozómy pro dýchání buňky, oxidativní
fosforylaci(složité membránové struktury) s tvorbou ATP.
Na membránu zevnitř nasedají ribozómy. Oblast jádra
je bez membrány a obsahuje vlákna DNA - bakteriální chromozóm haploidní. Za
nepříznivých podmínek vznikají spory. Velikost buněk o řád jednodušší i menší,
o řád rychlejší metabolismus (30 min. buň. čas.)
Bylo
zjištěno, že všechny prokaryotické organizmy lze zařadit do dvou zásadně
odlišných skupin: archebakterie (URL 216) a
eubakterie. V dnešní době dělíme veškeré organizmy do tří skupin: Eukarya
(označované i jako eukaryota), Bacteria (eubakterie), mezi které patří kromě
bakterií i sinice (URL
217) neboli modré řasy, a Archaea (archebakterie). Archebakterie žijí často v extrémních
podmínkách (např. v horkých pramenech Yellowstonského parku, nebo
v hlubokomořských vývěrech horké vody při teplotách značně vyšších než 100oC).
Mají geny zcela nepodobné běžným bakteriím, dokonce se u nich dost často
nacházejí geny, které jsou spíše podobné genům vyšších organismů, například i
genům lidským.
Jak archebakterie, tak i eubakterie jsou prokaryotické organismy: mají uzavřenou kruhovou molekulu DNA, spojenou transkripci a translaci a obvykle se množí dělením. Jsou však mezi nimi některé rozdíly. Jeden z nich je ten, že využívají různé metabolické cesty. Také se liší v počtu ribozomálních proteinů a ve velikosti a tvaru ribozomální S jednotky. Genom eubakterií je skoro dvojnásobný, a také obsahují více plazmidů než archebakterie.
Archebakterie
také nemají ve svých buněčných stěnách kyselinu muramovou, obsahují introny a
jsou rezistentní k antibiotikům která působí na eubakterie.
Archebakterie se podobají
eukaryotům tím, že mají několik druhů RNA polymerázy, mají větší počet histonům
podobných proteinů, jejich DNA tvoří nukleozomy a obsahují introny. U obou
zahajuje translaci methionin a mají homologní transkripční systém. Tyto
podobnosti řadí archebakterie blíže k eukaryotům než k eubakteriím.
Characteristika
|
Bacteria
|
Archaea
|
Eukarya
|
|
Obal jádra |
nemá |
nemá |
přítomen |
|
Organely ohraničené membránou |
nemá |
nemá |
přítomen |
|
Peptidoglykan v buněčné stěně |
přítomen |
nemá |
nemá |
|
Membránové lipidy |
Nerozvětvené uhlovodíky |
Některé rozvětvené uhlovodíky |
Nerozvětvené uhlovodíky |
|
RNA polymeráza |
Jeden druh |
Několik druhů |
Několik druhů |
|
Aminokyselina
startující syntézu proteinů |
formyl-methionin |
methionin |
methionin |
|
introny |
nemá |
přítomen v některých genech |
přítomen |
|
Citlivost k antibiotikům |
Streptomycin a
chloramfenikol inhibuje růst |
Tato antibiotika
neinhibují růst |
Tato antibiotika
neinhibují růst |
Součásti protocytu (URL 218)
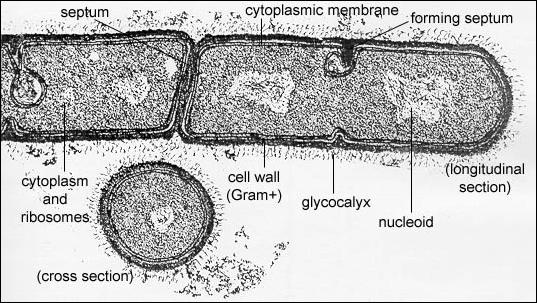
Prokaryotická buňka (Bacillus megaterium)
Copyright Dr. Gary Kaiser.
S laskavým svolením.
Buněčný
obal (cell
envelope, URL 219) se skládá ze dvou nebo tří vrstev: vnitřní
cytoplazmatické membrány, buněčné stěny, a u některých druhů bakterií vnější
mikropouzdro – kapsula.
Pouzdro,
kapsula (capsule,
URL 220) je třetí ochranný obal složený z různých
sloučenin, většinou bílkovin a polysacharidů. Označuje se také jako
glykokalyx , vnější viskózní vrstva obklopující buňku. Kromě jiného je jeho nejdůležitější funkcí
ochrana bakterie před vyschnutím a před fagocytózou většími mikroorganismy.
Kapsula je také hlavní virulentní faktor u většiny nemocí způsobených
bakteriemi (např. Escherichia coli a Streptococcus pneumoniae). Mutanty těchto
organismů, které nemají kapsulu, nejsou virulentní a proto nezpůsobují nemoci.
Bezbarvé kapsule obklopující
purpurově zbarvené bakterie
Copyright Dr. Gary Kaiser. S laskavým svolením.
Všechny bakterie vylučují nějaký
druh glykokalyxu. Ten se skládá z transmembránových
proteinů a na ně vázaných glycidů. Tvoří jej velké
množství vzájemně propletených polysacharidových vláken vystupujících z bakterie, mezi nimiž působí elektrostatické a jiné síly. Pokud tvoří rozsáhlý, pevně propojený a k buněčné
stěně přiléhající želatinový obal, označuje se jako kapsula. Pokud tvoří
glykokalyx neorganizovanou a k buněčné stěně jen slaběji vázanou vrstvu,
nazývá se slizová vrstva. Produkce glykokalyxu často závisí na podmínkách
okolního prostředí. Z mnoha funkcí glykokalyxu jsou dvě zvláště důležité:
způsobuje rezistenci bakterií vůči fagocytóze a umožňuje jim přilnout na různé
povrchy (kameny, zuby).
Buněčná
stěna (cell wall) se skládá
z peptidoglykanu (mureinu), což je molekula mukopolysacharidu. Obklopuje
cytoplazmatickou membránu, dává buňce její tvar a chrání ji před okolním
prostředím. Pomáhá také zakotvení bičíku a fimbrií, které vycházejí
z cytoplazmatické membrány a pronikají buněčnou stěnou ven. Síla buněčné
stěny také chrání buňku před roztržením v případě velkých rozdílů
osmotického tlaku mezi cytoplazmou a okolím.
Složení buněčné stěny je u bakterií velmi proměnné a
je také důležitým faktorem umožňujícím rozdělit bakterie na dva základní druhy,
gram-pozitivní a gram-negativní (URL
221). Tuto techniku, spočívající v barvení a následném vymývání
preparátu, objevil dánský lékař Hans Christian Gram v roce 1884.
Gram-pozitivní bakterie si zachovají nachovou barvu barviva, protože struktura
jejich mohutné buněčné stěny je zachycuje na rozdíl od buněčné stěny
gram-negativních bakterií, která barvivo při promytí v alkoholu či acetonu
uvolňuje. Gram-negativní bakterie mají tenkou peptidoglykanovou vrstvu, nad níž
je ještě membrána jiné konstrukce, ale s póry, které dovolují volný
přístup molekul (vnější membrána)
Struktura gram-pozitivní a gram-negativní buněčné stěny
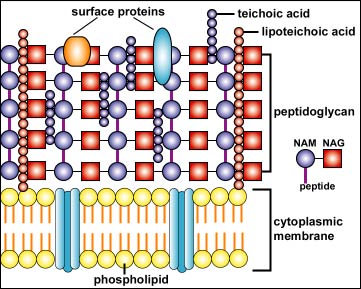
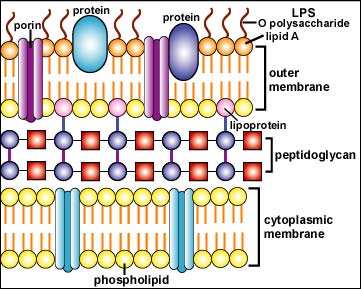
Struktura gram-pozitivní
buněčné stěny: jeví se jako hustá vrstva
složená z mnoha vrstev peptidoglykanu a molekul lipoteikoové kyseliny, na
jejímž povrchu se nachází teikoová kyselina a povrchové proteiny
Struktura gram-negativní
buněčné stěny: skládá se z tenké vnitřní
vrstvy peptidoglykanu a z vnější membrány složené z molekul
fosfolipidů, liposacharidů (LPS), lipoproteinů a povrchových proteinů.
Copyright Dr. Gary Kaiser. S laskavým svolením.
Cytoplazmatická
membrána (cytoplasmic membrane) je
dvojvrstva fosfolipidů obsahující proteiny. Reguluje tok látek mezi buňkou a
jejím okolím. Jedná se o dynamický, vysoce organizovaný útvar, který se stále
přizpůsobuje různým podmínkám vnějšího nebo vnitřního prostředí buňky.
Diagram cytoplazmatické membrány
Copyright Dr.
Gary Kaiser (URL 222).
S laskavým svolením.
Cytoplazma
(cytoplasm) tvoří vlastní obsah
buňky. Jedná s o matrici gelovitého charakteru složenou z vody,
enzymů, živin, odpadních látek a plynů. Obsahuje buněčné struktury jako např.
ribozomy a plastidy. V oblasti zvané nukleoid je lokalizován chromozom.
Jádro
(nucleoid) nemá typickou podobu jako
u eukaryontů. Je to oblast cytoplazmy, ve které se nachází chromozomální DNA,
neohraničená membránou. Většina bakterií obsahuje jeden kruhový chromozom
zodpovědný za replikaci, ačkoliv několik druhů obsahuje dva nebo i více chromozomů.
V cytoplazmě se také nachází menší kruhové řetězce DNA zvané plazmidy. Jedná se o malé,
mimochromozomální genetické struktury, které se nachází v mnoha druzích
bakterií. Na rozdíl od chromozomů se neúčastní na reprodukci. Genetické
instrukce pro zahájení a průběh buněčného dělení, nebo binárního rozdělení
(binary fission), které je nejčastějším způsobem rozmnožování bakterií, nesou
pouze chromozomy. Replikace plazmidů probíhá nezávisle na chromozomu. Pokud
nejsou přímo nezbytné pro přežití, zdá se, že dávají bakteriím selektivní
výhody.
Jsou přenášeny do jiných bakterií dvěma způsoby. U
mnoha typů plazmidů se kopie přenášejí do dceřinných buněk během rozdělování
buňky. Ostatní plazmidy však tvoří na buněčném povrchu struktury podobné
rourkám (druh fimbrií), které při konjugaci bakterií (proces, při kterém si
bakterie vyměňují genetické informace) přenášejí kopie plazmidů do jiných
bakterií. Ukázalo se, že plazmidy slouží jako nástroje pro přenos určitých
vlastností, jako je rezistence vůči antibiotikům a těžkým kovům, a faktory pro
virulenci nezbytné pro infikování živočišných či rostlinných hostitelů. Možnost
vložit do plazmidů specifické geny z nich tvoří účinný nástroj pro
molekulární biologii a genetiku, zvláště v oblasti genetického inženýrství.
Bičíky
(flagella, sing. flagellum) jsou
vlasům podobné struktury. Nacházejí se na jednom nebo obou koncích bakterie,
případně na celém povrchu. Pohybují se jako vrtule pomocí „motoru“ umístěného
těsně pod cytoplazmatickou membránou, a tím pomáhají bakteriím, které je
vlastní, v pohybu směrem k živinám, pryč od toxických chemikálií nebo
v případě fotosyntetizujících sinic směrem ke světlu.
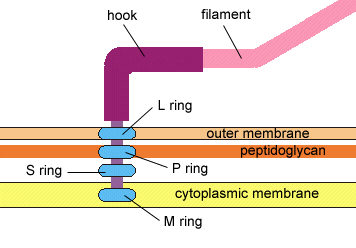
Struktura ukotvení bakteriálního
bičíku
Copyright Dr.
Gary Kaiser (URL 222).
S laskavým svolením.
Fimbrie
(pili, sing. pilus) jsou malé,
chloupkům podobné útvary složené z proteinů. Vystupují z povrchu
buňky a umožňují přichycení bakterií na jiné buňky nebo povrchy jako jsou zuby,
vnitřnosti nebo skály. Bez nich mnohé patogenní bakterie ztrácejí schopnost
infekce, protože se nejsou schopny přichytit k hostitelské buňce.
Specializované sexuální fimbrie, umožňují při konjugaci buněk výměnu fragmentů
plazmidové DNA.
Ribozomy
(ribosomes) jsou mikroskopické
„továrny“ nacházející se ve všech buňkách včetně prokaryontů. Překládají
genetický kód z molekulárního jazyka nukleových kyselin do jazyka aminokyselin,
stavebních prvků bílkovin. Bakteriální ribozomy jsou jsou podobné ribozomům
eukaryontů, ale jsou menší a mají poněkud odlišné složení a molekulární
strukturu. Bakteriální ribozomy se nikdy nevážou na jiné organely, jsou volně
rozloženy v cytoplazmě. Mezi bakteriálními a eukaryotickými ribozomy jsou
dostatečné rozdíly na to, aby některá antibiotika mohla inhibovat funkci
bakteriálních ribozomů, ale nikoli eukaryotických. Mohou tedy zabíjet
selektivně bakterie, ale nikoliv eukaryotické organismy.
Mesozomy (mesosomes). V bakteriích
se nacházejí váčkům nebo trubicovitým útvarům podobné membránové struktury
nazývané mesozomy, tvořené zřejmě vchlípením plazmatické membrány. Elektronový
mikroskop je zobrazuje jako sférické částice se strukturou podobnou ementálskému
sýru. Tyto struktury se vyskytují častěji u Gram-pozitivních než u
Gram-negativních organismů. Dříve se věřilo, že tvoří u bakterií cosi jako
ekvivalent mitochondrií, přisuzuje se jim však mnoho dalších funkcí.
V současné době neexistuje žádný uspokojivý důkaz o jejich speciální
biochemické či fyziologické funkci. Studie preparátů v elektronovém
mikroskopu naznačují, že mesozomy vznikají fixací artefaktů vchlípením
membrány. Některá pozorování naznačují, že mesozomy mohou mít nějaký vztah
k dějům souvisejícím s buněčným dělením.
Chromatofory – tylakoidy. Bakterie
nemají chloroplasty. Místo nich obsahují chromatofory, což jsou membránové
struktury, tvořené četnými záhyby plazmatické membrány. Chromatofory obsahují
tylakoidy podobné rostlinným, které u některých bakterií obsahují chlorofyl.
V těchto bakteriích probíhá fotosyntéza podobně jako u rostlin. Mnohé
z nich se hojně vyskytují v oceánech, řekách a jezerech. Uvolňují
kyslík, který umožňuje přežít vodním živočichům. Některé archebakterie mají odlišný
typ fotosyntézy: místo vody využívají sirovodík (URL223)
a místo kyslíku uvolňují síru.
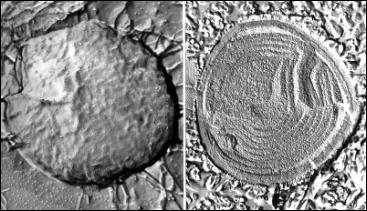
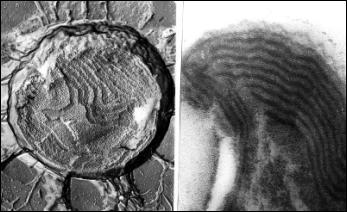
Sinice (URL 224) v elektronovém mikroskopu - na
prvním snímku vlevo povrch cytoplazmatické membrány, vpravo vnitřní struktura
(tylakoidy) obojí z rastrovacího elektronového mikroskopu, preparát připraven
technikou mrazového leptání (freeze etching), na druhém snímku vlevo vnitřní
struktura (tylakoidy, rovněž rastrovací elektronový mikroskop a freeze
etching), vpravo struktura tylakoidů v prozařovacím elektronovém mikroskopu
Extrémně
slanomilné halobakterie, nacházející se v solných plochách pouští, patří
mezi fototrofní archea. Jejich červené membrány obsahují bakteriorodopsin,
který má zcela jinou primární fotochemickou reakci než fotosyntéza založená na
bakteriochlorofylu. Bakteriorodopsin se skládá z pigmentu retinalu,
navázaného na membránový protein (opsin). Funguje jako jednoduché čerpadlo,
které v cyklické fotochemické reakci přenáší přes membránu vodíkové ionty.
Vzniklý gradient pohání enzymový komplex ATPázy, produkující ATP. Halobakterie
však neprodukují glukózu. Podobný pigmentový komplex, proteorodopsin, byl nalezen
i u mořských bakterií (eubakterií).
Příspěvek
fotosyntetických bakterií a fototrofních archeí ke globálním tokům energie a
uhlíku byl dosud považován za zanedbatelný. Poslední výzkumy však ukazují, že
tento názor bude zřejmě nutno přehodnotit. (Vesmír 9, 2002, str. 505).
Granula –
volutin (URL 225),
bakteriální glykogen: V cytoplazmě prokaryotických buněk se často
nachází nějaký typ inkluzních granulí. Jsou to ohraničená granula, která mohou
zabírat podstatnou část prostoru v cytoplazmě. Obvykle obsahují nějaký
druh materiálu, například glycidy (glykogen), tuky, bílkoviny a polyfosfátová
zrna (volutin). Zásoby uhlíku a energie mohou být uloženy ve formě glykogenu
(polymeru glukózy). Inkluze polyfosfátu jsou zásobárnami PO4. Síru
jako prvek ve formě globulí ukládají některá fototrofní prokaryota jako rezervu
elektronů či litotrofní prokaryota jako zásoby energie. Některé inkluzní
částice jsou ve skutečnosti membránou ohraničené měchýřky, které obsahují
fotosyntetické pigmenty (bakteriofyl v chlorozomech zelených bakterií a fykobilin–proteinový
(URL 226) komplex
ve fykobilizomech sinic) nebo enzymy (karboxyzomy u mnoha autotrofních bakterií,
kde tyto enzymy slouží jako místa pro autotrofní fixaci CO2).
Některé vodní bakterie také obsahují v tzv. magnetozomech magnetit (Fe3O4),
který jim slouží k orientaci při migraci podél siločár zemského
magnetického pole.
Prokaryotické organismy
se nacházejí ve všech prostředích, ve kterých je možný život. Pro růst svých
buněk mají obvyklé požadavky na výživu. Mnohé z nich však používají zcela
unikátní způsoby využití a transformace živin.
Prokaryotické organismy lze podle způsobu získávání
energie a živin dělit:
1)
1) Podle zdrojů uhlíku
–
–
Autotrofní: Autotrofní organismy
využívají jako zdroj uhlíku CO2 a energii získávají ze světla
(fotoautotrofní organismy) nebo oxidací anorganických sloučenin
(litoautotrofní)
–
–
Heterotrofní: Heterotrofní organismy
získávají uhlík pro růst z organických látek. Většina heterotrofních
prokaryotů jsou saprofyty, což
znamená že získávají živiny z mrtvých organismů. Saprofytické bakterie a
houby v půdě zodpovídají za biologickou degradaci organického materiálu.
Nakonec jsou organické molekuly degradovány až na CO2. Je však
pravděpodobné, že organické látky, které nevznikají přirozenou cestou, nemohou
být tímto způsobem degradovány.
2)
2) Podle zdrojů energie
–
–
Fototrofní: Fotosyntetizující prokaryota
mění světelnou energii na energii chemickou, kterou využívají pro růst. Mnohé
fototrofní bakterie jsou autotrofy, takže jejich role v uhlíkovém cyklu je
analogická jako u rostlin.
–
–
Chemotrofní: získávají energii oxidací
redukovaných látek.
Tyto dvě skupiny fyziologických variant jsou u
prokaryotů (na rozdíl od eukaryot) vzájemně kombinovatelné, takže bakterie
mohou být
|
Organismy |
Zdroj energie |
Zdroj uhlíku |
|
Fototrofní |
světlo |
|
|
světlo |
organické látky |
|
světlo |
CO2 |
|
Chemoorganotrofní |
organické látky |
|
|
organické látky |
organické látky |
|
Chemolitotrofní |
anorganické látky |
|
|
anorganické látky |
CO2 |
-
-
fotoautotrofní: Většina fototrofních
bakterií je autotrofních, takže jejich role v koloběhu uhlíku je
analogická jako u rostlin. Do této skupiny patří prokaryotní sinice (URL 194),
nacházející se také v mořském fytoplanktonu, kde svou fotosyntézou
vytvářejí podstatné množství kyslíku obsaženého v biosféře.

Sinice a na akvarijních rostlinách (foto V. Pelikán, s laskavým
svolením) (URL 58)
-
-
Fotoheterotrofní: Tento typ metabolismu
se nevyskytuje u eukaryot, ale v oceánech existují fotosyntetické
prokaryotické organismy, využívající jako zdroj energie světlo a jako zdroj
uhlíku organické sloučeniny. Patří mezi
ně tzv. aerobní fototrofní bakterie (URL
193), které jsou schopny vypínat a zapínat fotosyntézu. Aby uspokojily svou
potřebu metabolické energie, chovají se občas jako rostliny. Odhaduje se, že
tvoří nejméně 11% všech mikrobů v blízkosti povrchu oceánů.
-
-
Chemoautotrofní (chemolitoautotrofní): V ekosystémech hlubokomořských
sopečných vývěrů (Vesmír 79, 327, 2000/6) žijí chemoautotrofní bakterie
využívající různé redukované sloučeniny (Mn2+, Fe2+, H2,
H2S) uvolňované z vývěrů jako hlavní zdroj energie. Tyto
bakterie pak slouží jako zdroj organického uhlíku pro vyšší organismy, jako
jsou například termofilní červi rodu Alvinella.
-
-
Chemoheterotrofní
(chemoorganoheterotrofní): Jsou to parazitické bakterie. Některé (E. coli) žijí
v zažívacím traktu zvířat. Jiné, např. Salmonella, jsou patogenní.
viz URL
133
1.4.2. Eukaryotické buňky
se liší od prokaryotických buněk hlavně strukturou
jádra. To vytváří samostatný kompartment, oddělený od cytoplazmy jaderným
obalem. Jádro obsahuje více chromozomů. Jejich struktura je též složitější,
protože se na ní podílejí – na rozdíl od prokaryotního chromozomu, uloženého volně
v cytoplazmě – bílkoviny typu histonů, které vytváří spolu s DNA tzv.
nukleoprotein.
Rozdíly (URL 145) mezi
oběma typy buněk se však neomezují jen na buněčné jádro. Prokaryotické buňky
jsou velmi chudé na membránové systémy a jsou zpravidla menší (obvykle několik
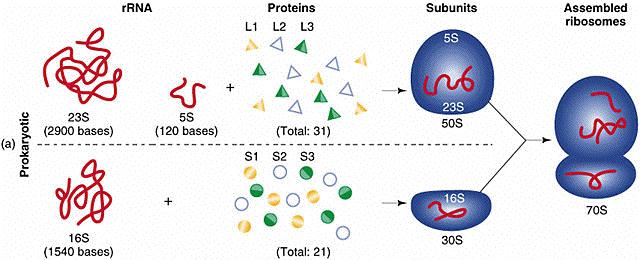
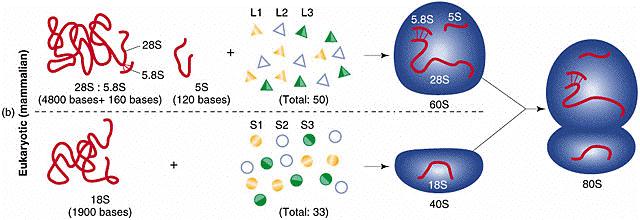
mikrometrů). Také ribosomy prokaryotních buněk (tzv. 70S ribosomy) jsou menší
než u buněk eukaryotních (tzv. 80S ribosomy). U prokaryotních buněk nebyly
nalezeny komponenty cytoskeletu. Velmi odlišný je také mechanismus buněčného
dělení.
Srovnání charakteristik prokaryot a eukaryot
|
Charakteristika |
Prokaryota |
Eukaryota |
|
Organely |
nepřítomny |
přítomny |
|
jádro |
ne |
ano |
|
jadérko |
ne |
ano |
|
Genetická
informace |
jediný
chromosom |
mnohočetné
chromosomy |
|
DNA |
obnažená |
spojená
s proteiny |
|
Množení
buňky |
dělení |
mitóza
a meióza |
|
Syntéza
proteinů |
spřažená
s transkripcí |
RNA
se tvoří v jádře; |
|
Energetický
metabolismus |
anaerobní
a aerobní |
aerobní |
|
Respirační
enzymy |
v
plasmatické membráně |
v
mitochondriích |
|
Buněčná
stěna |
přítomna |
Chybí,
ale je zde extracelulární matrix |
|
Cytoskelet |
ne |
ano |
|
Endocytóza
nebo exocytóza |
ne |
ano |
(URL 65)
Buňky s jádrem: Archezoa, Chromista, Protozoa,
Fungi, Plantae, Animalia.
Pro studium struktury buněk je nutné barvení
histologických preparátů nebo použití elektronové mikroskopie. V současnosti je
mnoho možností studia na internetu. Lze použít vyhledávače (www stránky - viz
seznam literatury).
1.4.2.1. Živočišné buňky
|
Živočich je heterotrofní eukaryotický mnohobuněčný
organismus, v jehož vývoji se vyskytují nejméně dvě vrstvy buněk
(stadium gastruly) --
Buňky jsou diferencovány k určitým
úkolům do souborů (tkání) --
Tkáně mohou vytvářet orgány nebo
soustavy orgánů zabezpečujících životní pochody a funkce živočicha, které
spolu logicky souvicejí: --
Příjem a zpracování organické potravy
(nutnost potravu v prostředí objevit, proto se vytvořily:) --
Dráždivost a orientace
v prostředí (registrace potravy, partnera, nepřítele … vyžaduje:) --
Schopnost pohybu buď celého živočicha
nebo jeho částí (Vlastnost pro živočichy charakteristická. Nepohybuje –li
se živočich, pohybuje se prostředí, ve kterém žije) --
Vyšší nervová a duševní činnost
(Není dána všem živočichům a zřejmě se nevyskytuje u jiných forem organizmů.) --
Složité vnitřní členění jak co do
počtu buněk a jejich typů, tak i co do rozmanitosti tkání a orgánů. Povrch
často jednoduchý. --
Schopnost reprodukce (Není výlučnou
vlastností živočichů – je charakteristická pro všechny organizmy) |
Mezi živočichy tedy dnes řadíme pouze organizmy
mnohobuněčné. Metabolismem příbuzné živočichům jsou buňky prvoků (říše
Protozoa).
Živočišné buňky, ač většinou vybaveny stejnými
základními organoidy, jsou často v průběhu tzv. ontogenetického vývoje (vývoje
jedince) velmi rozmanitě utvářené (diferencované) podle funkce, kterou
v daných souborech buněk mají vykonávat.
Jsou různé velikosti. Krvinky člověka měří 5 -7
mikrometrů, žahavci mají některé buňky dlouhé až 100 mm, nervové buňky mají výběžky až několik m. Největší živočišná
buňka je pštrosí vajíčko. Vnitřní prostor eukaryotických buněk je dělen
biomembránami na celou řadu tzv. kompartmentů,
čímž se rovněž liší od buněk prokaryotických.

krvinky člověka (URL 21) vejce pštrosa Emu (převzato z URL 68)
Živočišná buňka je oddělena od okolí plazmatickou
membránou. Uvnitř je metabolicky aktivní protoplazma, kterou v oblasti jádra
nazýváme karyoplazmou a mimo jádro cytoplazmou.
Kromě protoplazmy buňka obsahuje rozpuštěné zásobní, případně odpadní látky.
Jsou-li nerozpuštěné, nazýváme je inkluze.
Protoplazma obsahuje cytosol (dříve základní cytoplazma), organoidy ( tj. funkční buněčné struktury, též zvané
organely) a cytoskelet.
Rozdíly
mezi buňkami mnohobuněčných Eukaryot:
Rostliny: Buněčná stěna (celulóza a pod.), vakuoly jako
metabolicky aktivní membránová struktura, chloroplasty, nemají lysozomy, místo
dělícího tělíska mají cytocentrum, (symplast a apoplast, diplo- nebo
polyploidní). Zásobní látka - škrob.
Houby: buněčná stěna (chitin), vakuola, často haploidní,
ale i diploidní formy existence. Zásobní látka glykogen.
Živočichové: Bez buněčné stěny (s výjimkami - vejce), mají
centriol.
Nejsou zde metabolicky aktivní vakuoly, jen tukové či
turgorové ve struně hřbetní, diploidní forma existence, zásobí látka glykogen.
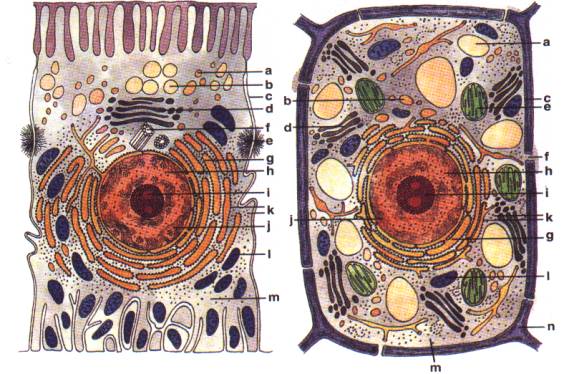
A)
B)
Stavba
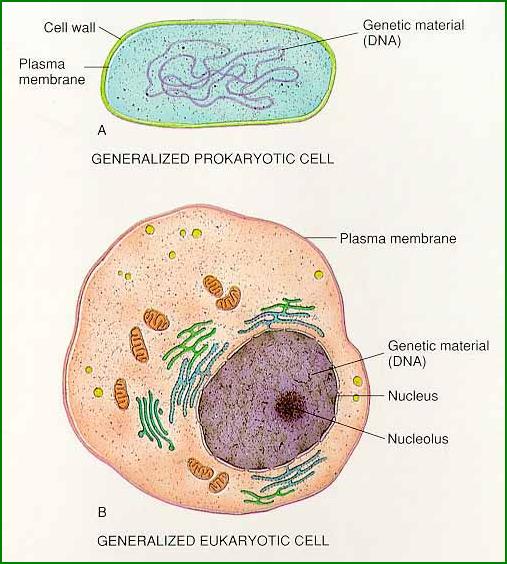
eukaryotické buňky (Rozsypal, 1994).
A)
Schéma živočišné buňky:
a - lysozóm, b - sekreční váček, c - plazmatická membrána, d - Golgiho komplex,
e - desmozóm, f - centriol,
g - endoplazmatické retikulum, h - jádro, i - jadérko, j - chromatin, k -
ribozómy, l - mitochondrie, m - základní cytoplasma.
B) Schéma rostlinné buňky:
a - vakuola, b - váček, c - plazmatická membrána, d - diktyozóm (Golgiho
tělísko), e - plastid, f - plazmodesm,
g - endoplazmatické retikulum, h - jádro, i - jadérko, j - chromatin, k -
ribozómy, l - mitochondrie, m - základní cytoplasma, n - buněčná stěna.
1.5. Struktura živočišné buňky:
a) Podle
tradičního dělení v buňce rozeznáváme
1. Cytosol
2. Funkční buněčné struktury
3. Buněčné inkluze
1.
1.
Cytosol
Cytoplazmu lze charakterizovat jako základní tekutou
složku buňky, tvořenou směsí koloidních a krystaloidních roztoků anorganických
a organických látek. Její hlavní funkcí je vytvářet vhodné prostředí pro
činnost všech buněčných organel a výměnu látek mezi nimi. Je sklovitě
průhledná, čirá, jednolomná (výjimečně dvojlomná - panožky Rhizopod), viskozita
je proměnlivá podle množství koloidů a vody. Při povrchu buněk bývá její
hustota vyšší a bývá v ní méně organel (hyaloplazma), uvnitř buňky bývá
řidší a s větším množstvím organel (granuloplazma). Je slabě kyselé až
neutrální povahy, pH kolem 6,8 (3,8 – 7,0). Z biochemických pochodů
v ní probíhá částečně přeměna bílkovin, štěpení cukrů (anaerobní glykolýza
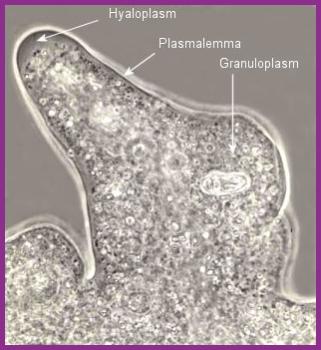
aj.) a přeměna tuků. Světelná mikroskopie umožňuje rozlišit tzv. hyaloplasmu a
granuloplasmu (URL 67)
Hyaloplazma – hustá, bezstrukturní, sklovitá hmota
(ektoplazma), která neobsahuje organoidy.
Granuloplazma – (endoplazma) se nachází zpravidla
blíže ke středu buňky, v okolí jádra, zrnitost v optickém mikroskopu
je dána přítomnosti organoidů (ER, ribozomy, mitochondrie).
(viz též URL
67)
Struktura cytoplasmy je určena prostorovým sestavením
makromolekul cytosolu a je v neustálém proměně. Podle vnějších pozorování
tradičními histologickými metodami lze rozlišit tři typy cytoplazmy: vláknitou,
hyalinní a granulární.
Tyto tři typy cytoplasmy se liší prostorovým
uspořádáním globulárních makromolekul:
1.
1. – lineární seřazení globulí (vláknitá struktura
cytoplasmy)
2.
2. – plošné spojení globulí (vločkovitá struktura
cytoplasmy)
3.
3. – prostorové uspořádání globulí (zrnitá struktura
cytoplasmy
Látkové
složení základní cytoplazmy:
Je značně proměnlivé v čase. Lze je jen odhadnout,
neboť stanovení kvantitativního složení základní cytoplazmy je metodologicky
náročné: Není totiž možno izolovat větší množství čisté cytoplazmy zbavené
organoidů v ní obsažených. K určité představě o jejím složení lze
dospět odečtením látkového složení jednotlivých organoidů od látkového složení
buňky jako celku. Samotné organoidy je totiž možné izolovat. Přibližné procentuální
zastoupení jednotlivých látek v cytoplazmě je následující:
60% vody, 4,3% minerálních látek, 35,7% organických
látek.
Glycidy - 6,2%, lipidy 11,7%, bílkoviny (proteiny)
17,8% a to: albuminy, globuliny, aminokyseliny, fosfolipoproteiny), nukleotidy,
ADP a ATP, barviva (glycidy).
Cytoplasmu nelze charakterizovat jako tekutinu ani
jako tuhou látku. Jedná se o různorodý koloidní systém prostoupený měnící se
sítí vláken a tělísek. Z fyzikálního hlediska je pro ni charakteristické
dvojí skupenství koloidů: gel a sol (URL
69). Jejich vzájemná přeměna je v cytoplazmě zvratná – závisí na
vzniku a zániku vazeb mezi jednotlivými částicemi systému. Gel je
charakteristický pro soustavy vláknitých micel, stav solu pro soustavu micel
globulárních. V hyaloplazmě převládá gelová struktura koloidů,
v granuloplazmě skupenství solu.
V základní cytoplazmě probíhá: přeměna bílkovin a
ribonukleových kyselin, štěpení polysacharidů, zmýdelňování tuků.
Hyaloplazma - udržuje tvar buňky a spolu s
cytoplazmatickou membránou se podílí na zajištění výměny látek mezi buňkou a
prostředím. Přesuny živin uvnitř buňky, umožňuje je i existence organoidů.
Změna viskozity - astrosféra + centriol (v době mitózy).
2. Funkční
buněčné struktury (buněčné
organoidy, organely)
Jsou to ohraničené struktury charakteristických tvarů
nacházející se uvnitř buňky, které zastávají v buňce specializované úkoly
významné pro plnění životních funkcí.
3. Buněčné inkluze
jsou tělíska nebo kapénky rezervních
nebo odpadních látek. Samy o sobě se nemohou podílet na životních pochodech,
neboť jsou chemicky inaktivní. Pokud se zapojují do biochemických pochodů, děje
se tak pod vlivem látek přítomných v okolní cytoplazmě.
b) Podle
výsledků elektronové mikroskopie lze v živočišné buňce rozlišit následující
organoidy:
|
1. buněčné
obaly (m)
(m = membránový organoid) 2. jádro
(m) 3. jadérko 4.
mitochondrie (m) 5.
endoplazmatická síť (m) 6.
ribozómy 7. dělící
tělísko (centrozóm) centriol 8.
lysozómy (m) 9. Golgiho
komplex (aparát) (m) 10. mikrotělíska (m) 11. cytoskelet (buněčné fibrily, mikrotubuly) 12. buněčné inkluze (metaplasma) (m – někdy) (zásobní látky) 13. peroxizómy (m) |
1.5.1. Buněčné obaly
Cytoplazmatická membrána - jemná optickým mikroskopem neviditelná hraniční
blanka, přítomná u všech buněk.
Morfologická membrána - buněčná stěna - silnější, zevně uložena,
mikroskopem dobře patrná. Typická pro buňky rostlin, u živočichů se vyskytuje
vzácně (vejce plazů nebo ptáků, jednostranně u kutikuly, u Protozoí).
1.5.1.1. Cytoplazmatická membrána
(plazmolema, fyziologická blána buněčná): Tvoří
rozhraní mezi buňkou a prostředím mimo buňku. Je to polopropustná (dnes spíše selektivně propustná) blána, která
umožňuje osmózu a vzhledem k možnosti pronikání určitých iontů je selektivně
propustná, tj. dochází k asymetrii v rozložení látek mezi buňkou a prostředím.
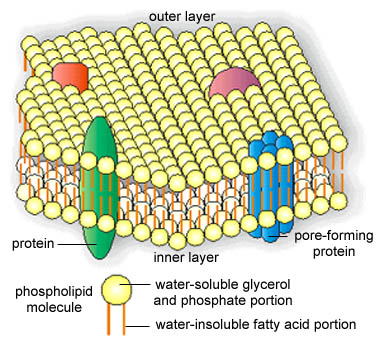
Podle současných představ je tvořena dvěma vrstvami
kolmo k povrchu buňky orientovaných molekul tukových látek a vně i uvnitř k nim
pevněji či volněji vázanými vrstvami bílkovin (lipoproteinová membrána).
Podobné jsou i ostatní biomembrány v buňce.
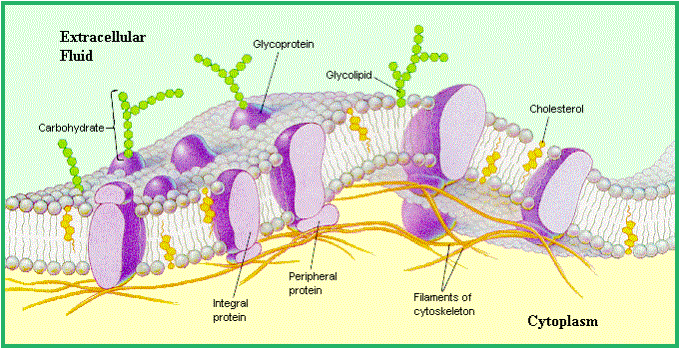
Cytoplazmatická membrána (URL 70)
Morfologické diferenciace CPM (URL
72) - kinocilie, stereocilie, mikroklky, bazální labyrint epitelů aj.
Bílkovinné makromolekuly mohou být na lipidové
dvojvrstvě cytoplazmatické membrány
a)
a) vázané na povrchu,
b)
b) vklíněné uvnitř,
c)
c)
prostupující membránu, kterou tvoří
dvojvrstva tzv. fosfolipidů.
Mohou se zde vázat i cerebrosidy a steroidy
(cholesterol)
Hydrofilní části tuků: zbytek kyseliny
ortofosforečné, cholin, kolamin, glycidy
Hydrofóbní části - zbytky mastných kyselin
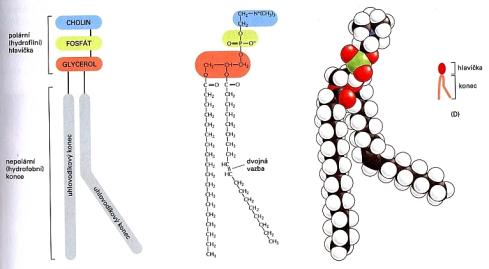
Struktura fosfolipidu
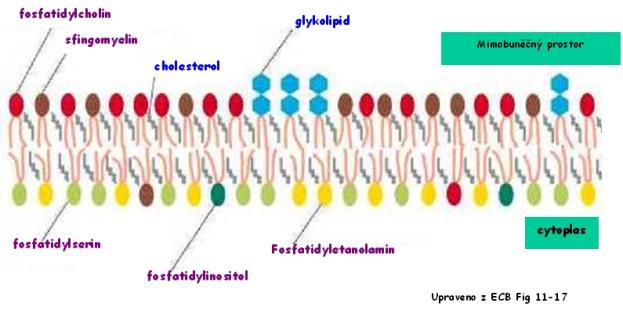
(fosfatidilcholin) různým způsobem vyjádřená (Bruce a kol., 1998)
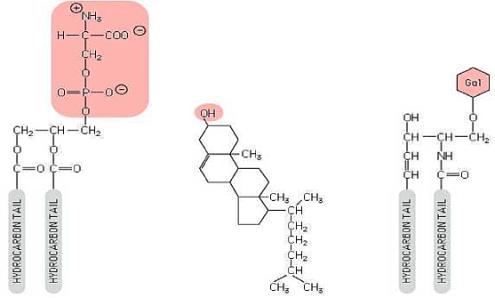
Tři
skupiny membránových lipidů.
Vpravo
příklad fosfolipidu (fosfatidilserin), uprostřed cholesterol, vlevo glykolipid.
Růžově označená jsou místa umožňující další vazby.
Asymetrie lipidové dvojvrstvy
Vnější a vnitřní vrstva cytoplazmatické membrány se
od sebe svým složením poněkud liší:
-
-
uvnitř se nachází jiný poměr fosfolipidů
a glykolipidů vež ve vnější vrstvě
-
-
membránové proteiny mají specifickou
orientaci
Membránové lipidy nejsou v buňce rozloženy
rovnoměrně po obou stranách membrány.
Nejpřesvědčivější důkaz této skutečnoti poskytuje membrána erytrocytu,
jejíž všechny cholinové fosfolipidy (fosfatidylcholin a sfingomyelin) jsou
umístěny na vnější straně a aminofosfolipidy (fosfatidyletanolamin a
fosfatidylserin) jsou umístěny na cytoplazmatické straně membrány. Tato
asymetrie je aktivně udržována tzv. na ATP závislou „flipázou“, která převrací
fosfolipidy na správnou stranu membrány.
Asymetrie
membrány (URL 73)
má pro život buňky velký význam. Ztráta této asymetrie hraje například velkou
roli v procesu aktivace krevních destiček a srážení krve. Aktivace
krevních destiček má za následek vystavení fosfolipidů anionického charakteru,
zvláště fosfatidylserinu, na jejich povrchu. Stejně tak jsou tyto molekuly
fosfatidylserinu vystaveny na povrchu zestárlých erytrocytů. To je signálem pro
rozpoznání makrofágy. Buňky, u nichž probíhá apoptóza (= programovaná buněčná
smrt) vystavují totiž na vnější straně své plazmatické membrány velké množství
molekul fosfatidylserinu, zatímco u buněk nepodléhajících apoptóze se takřka
všechny molekuly fosfatidylserinu nacházejí ve vnitřní vrstvě membrány. Tato
asymetrie v distribuci fosfolipidů může také ovlivňovat aktivitu enzymů.
Mnohé v cytosolu obsažené proteiny se totiž vážou na plazmatickou membránu
pomocí elektrostatické interakce s fosfolipidy nesoucími elektrický náboj
(fosfatidylová kyselina,
fosfatidylinositol a fosfatidylserin).
Cytoplazmatická membrána (URL 71) a
jiné membrány v buňce (biomembrány) mají při fyziologických teplotách tzv. "fluidní" charakter -
jednotlivé složky membrány i bílkoviny se mohou pohybovat po povrchu, pokud
nejsou vázány na vnitrobuněčné struktury.
Charakterizujíce CPM hovoříme o modelu tekuté mozaiky - viz URL 70 (Fosfolipiody
bakteriálních CPM si mohou vyměnit souseda až desetmilionkrát za sekundu a
pohyb na druhý konec buňky stihnou přibližně za 1 sec.)
Tekutost CPM (a ostatních biomembrán) je základní
podmínkou jejich bezporuchových funkcí, např. i z hlediska imunitních reakcí.
Je ovlivňována i obsahem cholesterolu. U některých typů buněk (např. epitely,
kde jsou buňky polárně orientovány) nebo u určitých organoidů se setkáváme s
omezenou fluiditou.
Eukaryotická buňka je biomembránami rozdělena na řadu
membránových compartmentů. V živočišných buňkách tvoří podíl membrán až
polovinu objemu buňky. Celkový povrch biomembrán je údajně velmi vysoký, např.
u hepatocytu (jaterní buňky) je to až 0,11 mm2. Z toho
samotná CPM zaujímá jen asi 2%.
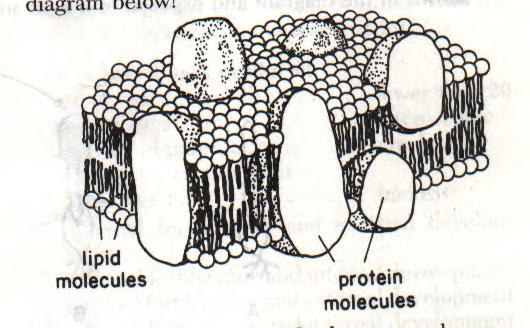 Model tekuté mozaiky (převzato z URL
178)
Model tekuté mozaiky (převzato z URL
178)
V membráně se nachází celá řada tzv. membránových
bílkovin, které v různé formě membránou prostupují, nebo jsou do ní z jedné či
druhé strany vklíněny. Na bílkoviny vně buňky vážou se ještě zbytky tuků nebo
sacharidů a vytvářejí komplex zvaný glykokalyx. Ten představuje „tvář“ buňky a
determinuje její funkční schopnosti. Uvnitř se mnohé membránové bílkoviny váží
na cytoskelet nebo souvisejí s biochemicky aktivními látkami.
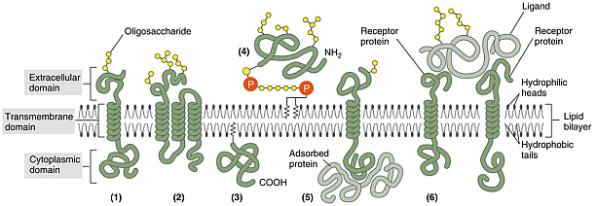
Model CP
membrány. Nahoře extracelulární, dole intracelulární prostor. Proteiny bývají asociovány s vnější nebo vnitřní
vrstvou nebo jde o bílkoviny transmembránové. Na ně se mohou vázat další látky
(např. cukry aj.) podle vazebných míst (adresy) proteinů. Tím vzniká
charakteristický glykokalyx buňky a místa pro registraci podnětů, ať již
fyzikálních, chemických, či biologických.
Proteiny
v CPM zajišťují:
1. usměrněný transport,
2. katalýzu membránových reakcí,
3. vazbu glykokalyxu vně buňky,
4. spojení mezi glykokalyxem a cytoskeletem uvnitř
buňky,
5. tvoří receptory pro příjem chemických signálů
Membránové proteiny tedy, obecně řečeno, zajišťují tok
látek, energie a informací mezi vnějším prostředím a buňkou.
Ve vnější vrstvě plazmatické membrány se nachází
glykolipidy. Většina bílkovin v membráně jsou glykoproteiny, ke kterým
jsou připojeny krátké řetězy molekul cukru (oligosacharidů). Proteoglykany jsou
membránové proteiny, ke kterým je připojen jeden nebo více dlouhých
polysacharidových řetězců. Všechny uhlovodíky z glykoproteinů,
proteoglykanů a glykolipidů, nacházející se na vnější straně plazmatické
membrány, tvoří cukerný povlak zvaný glykokalyx. Ten chrání povrch buňky před mechanickým
a chemickým poškozením a činí jej kluzkým tím, že adsorbuje vodu. Prokázány
byly i další látky: Ca2+, RNK...
Podle složení se mění vzhled i funkce membrány. Její síla je asi 7,5 nm (6-20
nm).
1.5.1.2. Průchod látek membránou (hypotézy)
1. Prostou difúzí (kterou buňka nereguluje) - po koncentračním spádu.
Tímto způsobem pronikají přes CPM plyny,
molekuly lipofilní povahy (uhlovodíky, např. benzen, mastné kyseliny,
organické kyseliny, etery, steroly, malé neutrální hydrofilní molekuly, které
nejsou nabité - voda, alkoholy, močovina). Rychlost difúze určité látky závisí
např. na jejím koncentračním spádu na obou stranách biomembrány. ale i na
teplotě nebo velikosti molekuly. Difúze probíhá do vyrovnání koncentrace.
D=K.1/√M, proto látky o
malé molekulové hmotnosti difundují rychleji.
Bez problémů procházejí plyny. (Důležité pro
dýchání!)
Také lipofilní látky rozpustné v tucích projdou
mezerami mezi bílkovinami a střední vrstvou bez problému, bez ohledu na
velikost molekul. Čím méně rozpustné v tucích, tím pomaleji difundují
membránou. Protože však procházejí i látky hydrofilní, existuje domněnka o existenci jemných pórů
vyplněných vodou. Takto procházejí některé ionty a některé část aminokyselin,
jednoduché cukry a nízkomolekulární bílkoviny.
V průniku látek cytoplazmatickou membránou hrají
významnou roli tzv. transmembránové
kanály. Jsou vytvořené specifickými proteiny, které umožňují průnik látek
hydrofilních, v tucích nerozpustných. (Např. iontové kanály pro Na+ a K+ v membránách nervových buněk.) Na průchod není nutné
dodávat energii. Některé jsou otevřené stále, jiné jen občas. Jejich funkci lze
regulovat.
Elektrolyty jsou při pronikání membránou ovlivněny
elektrickými náboji pórů membrány. Ty
mohou být totiž vystlány buď kladně nebo záporně nabitými funkčními skupinami
bílkovinných vrstev, které ze svého okolí přitahují opačně nabité ionty a tak
urychlují jejich pronikání membránou. Protože v membráně převažují
pozitivní náboje, vstupují anionty do buňky snadněji než kationty. Schopnost
iontů pronikat plazmatickou membránou však klesá se stupněm ionizace. Slabé
kyseliny a zásady pronikají lépe než silné. Jednomocné kationty pronikají
snadněji než vícemocné. U prvků stejného mocenství je jejich prostupnost
membránovými póry omezena velikostí hydratovaných iontů.
Vliv nábojů
v obalu póru: přitahují opačně
nabité ionty a urychlují tím jejich průnik membránou. Převaha pozitivních
nábojů znamená, že- anionty snadněji pronikají, převaha kationtů - pokles se
stupněm ionizace. Slabé 1-mocné lépe. Kationty - vliv pláště v hydratovaných
iontech. Snadnost v pronikání (postupně klesá): NH4+, K+, Na+, Li+ Mg2+, Ba2+, Sr2+, Ca2+, CNS-, I-, NO3, CL-.
Difúzní koeficient
D = K . 1 /√ M
tj. menší molekuly difundují rychleji.
Transport
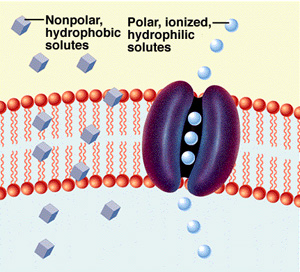
přes membránu prostou difuzí (URL 74)
Nepolární
látky procházejí volně přes CPM, polární, hydrofilní (ionty) prostřednictvím
iontových kanálů.
2.
Usnadněnou difúzí. Při ní dochází k
dočasnému spojení přenášené látky s tzv. "nosičem". Komplex je rozpustný v lipoidní vrstvě
membrány a šíří se jí po koncentračním spádu bez potřeby energie. Tento proces
je vysoce specifický. Pasívní přenašečový transport je tzv. "usnadněná
difúze". Tímto způsobem se přenášejí např. aminokyseliny, monosacharidy,
disacharidy, fosfátové ionty. Přenos je někdy specifický, jindy nespecifický.
Transmembránová bílkovina váže přenášenou látku a jakýmsi způsobem ji dostane
přes membránu. Snad to souvisí se změnou terciární nebo kvartérní struktury
proteinu. Látky pronikají po koncentračním spádu bez potřeby energie.
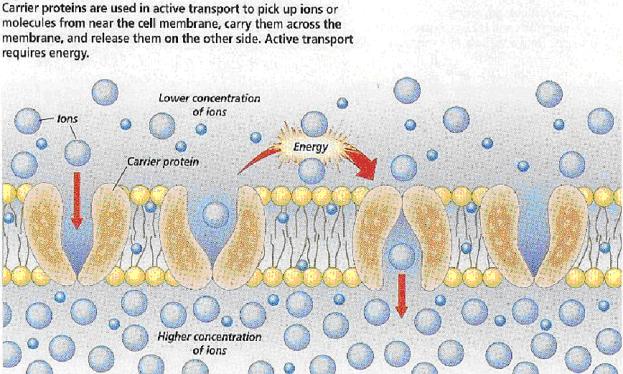
3. Aktivní
transport vysvětluje nerovnoměrné
rozložení látek uvnitř a vně buněčné membrány.. Přenašeči (enzymy) zachytí
molekulu vně a přenesou ji i proti koncentračnímu spádu dovnitř. Tento proces
vyžaduje energii, a tedy spotřebovává ATP syntetizovaný v mitochondriích. Jedná se o vysoce selektivní proces, který
je omezen na určité úseky membrány.
Aktivní transport
je proces, kdy jsou přenášeny přes membrány látky proti koncentračnímu
spádu za účasti transmembránového proteinu a za spotřeby energie. Jedná se tedy o proces působící v opačném
směru než jednoduchá či usnadněná difuze.
Rozeznáváme 3 typy aktivního transportu: membránové
pumpy, endocytóza a exocytóza.
Na vazbu přenášené látky
z prostředí mimo membránu je třeba energie. Nahoře – nižší koncentrace
iontů žádaných uvnitř buňky, kde je jejich koncentrace vyšší (Podobně pracuje
např. protonová pumpa v membránách lysozómů. Transportem protonů dobnitř
váčku se okyselí vnitřní prostředí a aktivují trávící enzymy.) (URL 76)
a)
Sodíko-draslíková pumpa
Má za cíl udržet potřebné koncentrace Na+
a K+ iontů uvnitř buňky a mimo buňku. Běžně se sodík dostává do
buňky snadno a jeho koncentrace převyšuje potřebu, zatímco draslík zůstává
spíše mimo buňku, avšak je zde potřebný. Proto běžně
2K+- čerpány do
buňky, 3Na+ - čerpány z buňky za spotřeby 1 ATP. Změny
koncentrace iontů v intra- a extracellulárním prostředí umožňují rovněž
vznik elektrického potenciálu a např. vedení vrzruchu po membráně nervové buňky
nebo svalového vlákna.
b) b) Protonové (H+) pumpy (umožňují přesun protonů přes membrány. Tím se buď
vytvoří protonový gradient sloužící k jako zdroj energie k jiným reakcím
(mitochondrie), nebo se vnitřní prostředí okyselí a tím se aktivují příslušné
enzymy (lysozomy).
c) c) Ca2+ pumpa v membránách svalového vlákna umožní
měnit koncentraci v extramembránovém prostoru a tím následné reakce
v cytoskeletu,
b)
Vstřebávání živin v trávicí soustavě střevním epitelem
c)
(Vylučování) vstřebávaní odpadních látek z krve exkrečními epitely v ledvinách, zpětná resorbce H2O, glukózy, aminokyselin v kanálcích nefronu.
Přenašeči - permeázy - transportní ATPázy
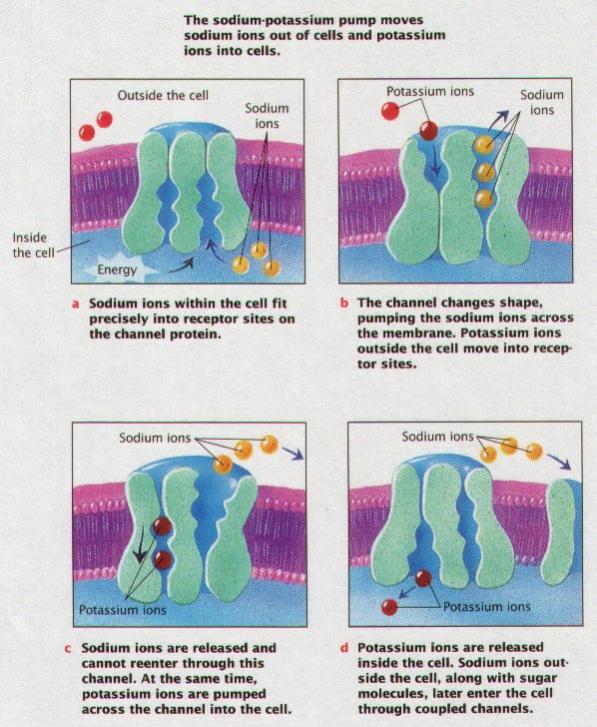
Na-K pumpa:
za spotřeby 1ATP se přes membránu přenesou 3 ionty Na+ ven a 2 ionty K+ dovnitř buňky. (Potassium -
draslík, inside - uvnitř, outside- venku). (URL 76)
Sekundární
aktivní transport – (URL 177)
jde o spřažení dvou pochodů, kdy jeden potřebuje
dodání energie a druhý těží z takto vniklého koncentračního gradientu (synport a antiport). Příkladem může být stejnosměrný přenos glukózy (potřeba
ATP) a Na+ ve střevní sliznici.
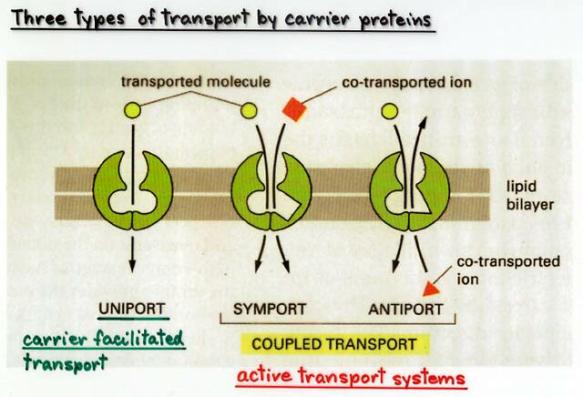
(převzato z URL 75)
Sekundární aktivní transport:
1.
1. Využívá podobné proteiny jako usnadněná difuze
2.
2. Spojuje pohyb několika různých molekul do jednoho cyklu
3.
3. Kotransport přenáší dvě nebo více molekul přes
membránu stejným směrem
4.
4. Opačný transport (counter transport) přenáší molekuly
v opačných směrech
5.
5. Gradient vzniklý transportem jedné molekuly může být
příčinou pohybu jiné molekuly proti jejímu vlastnímu gradientu
6.
6. Normální aktivní transport (Na-K ATPáza) vytváří
silný gradient Na, který naopak umožňuje mnohé mechanismy sekundárního
aktivního transportu (např. kotransport Na a glukózy)
Skupinová
translokace -
jde o pochody, při nichž je transportovaný substrát
chemicky změněn. Přenašeči jsou enzymy, které se na vnější straně s přenášenou
látkou váží a tuto pak na vnitřní straně uvolňují jako produkt chemické reakce.
Energie na proces se získává z této chemické reakce. Takto jsou transportovány
disacharidy ve sliznici tenkého střeva, které jsou hydrolýzovány na
monosacharidy, jež jsou uvolňovány dovnitř buňky.
Obecně cytózy (splývání
CPM buněk a váčků dovnitř nebo ven)
1. endocytózy - dovnitř
a)
a)
fagocytóza
–
- Pohlcování velkých částic nebo i celých buněk
(objevil ji Mečnikov u bílých krvinek)
- Výživa
prvoků, živočišných hub a láčkovců.
-
-
Obranný mechanismus - fagocytovány jsou
škodlivé částice i mrtvé buňky -makrofágové (histiocyty), nebo bakterie -
mikrofágové (neutrofilní granulocyty)
b) b) pinocytóza
- zachycování drobných kapének
tekuté potravy buněčným povrchem a transport dovnitř v podobě pinocytózních
váčků. Po asimilaci zbytky jsou vypuzeny exocytózou.
c)
c) endocytóza s účastí receptorů (adaptiny - urychlení koncentrace přenášené látky a
klatriny (URL
175, URL
179) – soudržnost váčků),
|
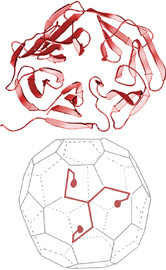
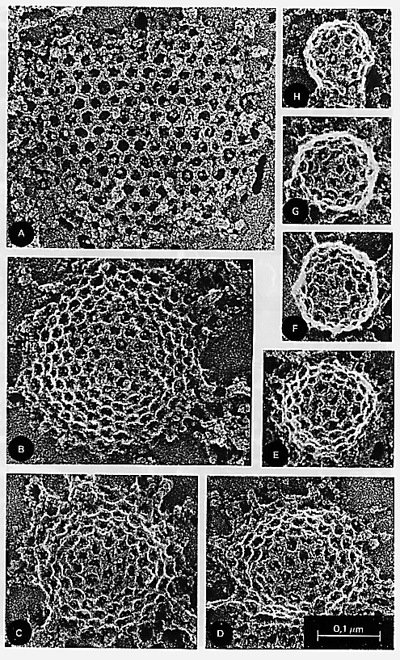
|
Clathrin is essential for sorting and transport within the cell. Tom Kirchhausen and his colleagues solved the crystal structure of the foot of clathrin, a protein involved in receptor-mediated endocytosis. The overall clathrin molecule consists of three legs radiating from a central hub. (převzato z URL 181) |
 Klatrinové váčky. Převzato z URL 180
Klatrinové váčky. Převzato z URL 180
2. exocytózy – látka se dostává mimo buňku
-
-
roztoku (produkt buňky)
-
-
pevné částice (nestrávené zbytky)
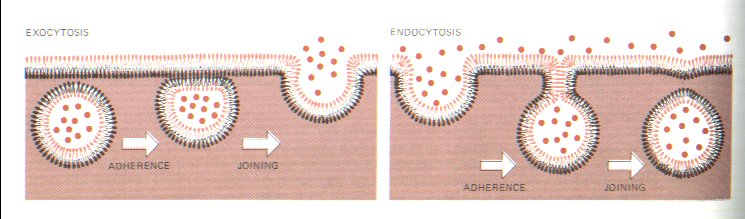
(URL 81) Příklad exocytózy (vlevo) a
endocytózy (vpravo) umožněných splýváním membrán.
3. transcytózy ( Např. pinocytóza - buněčné pití - na jedné straně pinocytózní váčky
jsou buňkou přijaty a na druhé straně opět vyloučeny. Projdou bez změny. Viz URL 182)
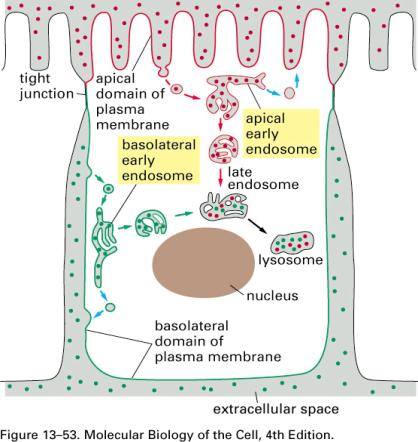
Obrázek
ukazuje soustavu tří polarizovaných buněk epitelu
Pinocytózní
váčky vznikající na jedné straně buňky vyloučí svůj obsah na druhé straně
buňky.
Viz též:
Převzato z URL 82
4. syncytózy
splynutí membrán celých buněk – syncytia (URL 183) – např.vznik svalového vlákna žíhané
svaloviny. Vznikají někdy také v důsledku virové infekce:
5.
tunelující nanotrubičky
V poslední době byl
objeven nový druh komunikace mezi živočišnými buňkami, tzv. tunelující
nanotrubičky. Mohly by být živočišnou obdobou rostlinných plazmodesmů Jejich
průměr je 50 – 200nm, délka několik buněčných průměrů. Jsou schopny
zprostředkovat kontakt mezi buňkami. Obsahují aktin, který se podílí i na
tvorbě cytoskeletu. Viz (8), nebo též URL
217, URL 218
URL 219.
1.5.1.3. Morfologická membrána
Je nutná při požadavku na pevnost buňky. Na rozdíl od
CM jsou morfologické membrány volně propustné. Typické jsou pro rostlinné buňky
- celulóza. (URL
77).
U živočichů: na povrchu vaječných buněk (sliz u
obojživelníků),
na povrchu těl prvoků (i uvnitř),
na
vnějších stranách krycích (a výstelkových) epitelů (chitin, tunicin).
Buňky hub obklopuje buněčná stěna. Není to pouze inertní
vnější vrstva,ale hraje důležitou roli ve fyziologii hub: v morfogenezi,
transportu metabolitů, sekreci proteinů, signalizaci a kontaktu mezi buňkami. (URL 79)
1.5.1.4. Mezibuněčné hmoty
Jde o výměsky buněk, které mají buňky buď mechanicky
chránit nebo vytvářejí charakteristiku tkáně.
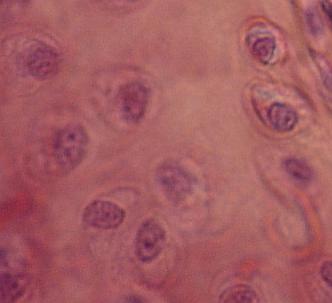
Příklad
velkého množství mezibuněčných hmnot např v chrupavce, kde během
diferenciace buněk směrem - mesenchym – chondroblast – chondrocyt - dojde
k vyloučení mezibuněčných hmot (matrix) do prostoru kolem buněk. Jádra
patří chondrocytům, cytoplasma slabě ohraničena a zbytek vyplněn mezibuněčnou
hmotou.Viz též (URL
80)
1.5.2. BUNĚČNÉ JÁDRO
(Karyon, nucleus, vesicula germinativa) se nachází
téměř ve všech živočišných buňkách.
Tvar bývá velmi rozmanitý - kulovitý, oválný,
protáhlý, tyčkovitý, rohlíčkovitý, rozvětvený, ~sluchátka~-činkovitý,
korálkovitý.
Uloženo zpravidla ve středu buňky, jinak tomu u
vajíček, tukové buňky, svalového vlákna.
Haberlondtovo pravidlo: jádro leží v místě
nejintenzivnějšího metabolismu.
Velikost jádra závisí na stáří a funkci buňky, staré
buňky mají menší jádra než mladé, žlázy mají velká jádra (asi podle poměru
euchromatinu a heterochromatinu).
Korelace jádro-plazmová - N/P = K
(N = hmota
jádra, P = hmotnost základní cytoplazmy, K = konstanta)
Polyploidní buňky mají velká jádra a jsou i větší.
Korelace jádro-plasmová neplatí v době rýnování
vajíček
Počet - jedno i více jader - plasmodia (mitózy uvnitř
buňky), syncytia (splynutí buněk)
Dvojjaderné buňky nálevníků - i rozdílné funkce –
makronukleus (vegetativní), mikronukleus (generativní, genetická).
Hlavní části jádra :
1. Jaderná membrána
2. Jaderná šťáva
3. Chromatin (zrnitý a vláknitý)
4. Nukleoskelet
5. Jadérko (i více) – samostatná organela
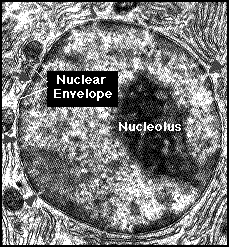
Struktura jádra eukaryotické buňky. Jaderná membrány (nuclear envelope), jadérko – nucleolus.
Jaderná
membrána (karyolema, karyoteka)
je tvořena lipoproteinovými vrstvami. Je silnější než
CM, jednotkové membrány jsou 2 a mezi nimi se nachází perinukleární prostor
(20-100 nm). Karyolema - selektivně propustná s mechanismem usnadněné difúze a
aktivního transportu. V membráně se nacházejí otvory (20-50 nm), tvořené
specifickými proteiny – poriny. Jsou nutné zejména pro průchod makromolekul RNK
(t-, m-, r-).
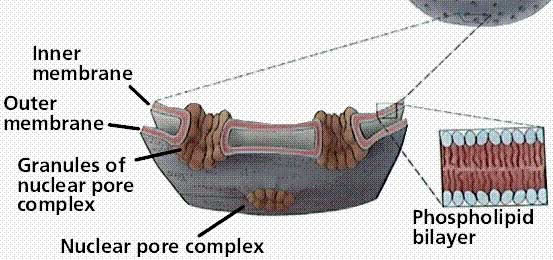 (URL 92)
(URL 92)
Karyolymfa
(jaderná šťáva), základní hmota, v
niž je rozptýlen
chromatin ve tvaru zrnéček nukleových kyselin. Je-li DNK
svinutá v komplexu s barvitelnými bílkovinami, tvoří barevné nebo
v EM snímcích tmavé skvrny tzv. heterochromatinu. Úseky DNK
rozvinuté, k přepisu genetické informace tvoří nebarvitelné nebo špatně
barvitelné, v EM snímcích světlé oblasti, tzv. euchromatin.
Karyoskelet – proteiny (laminy) zpevňující zevnitř karyoteku a
umožňující fixaci jednotlivých úseků nukleových kyselin. Uplatńují se též při
buněčném dělení, kdy se rekonstruuje jaderný obal.
Jadérko
(nucleolus) - 1 či více
světlolomných tělísek – viz dále
Ribozomy -
též v jádře zjištěné.
Chromozómy
- vznik v době dělení jádra (kromě polytenních chromozomů, ty jsou v jádře
přítomné v interfázi).
Chemické
složení jádra
DNK (chromatin), klidový stav mimo dělení, RNK poblíž
chromocenter v chromatinu - dynamický stav – při přepisu informace.
DNK + histony (nukleohistony) = bílkoviny, nebo
protaminy ve spermiích sledů.
Jiné bílkoviny: globuliny (fermenty), kyselé
bílkoviny (vazba s RNK), fibrilární a nerozpustné bílkoviny (kolageny - pevné
struktury jádra), Lipidy - fosfatidy, steroly.
Funkce
jádra
Genetická - (replikace DNA) - uchování genetické
informace v DNK. Při dělení buňky dojde k rozdvojení DNK a její resyntetizaci
ve fázi klidové (aktivace některých úseků DNK - biochemické procesy).
Metabolická - řídí některé metabolické procesy buňky
(syntéza RNK, glycidů, ATP, enzymů). Buňky s vysokou úrovvní metabolismu
mají špatně barvitelná, světlá jádra.
1.5.3. Jadérko (nucleolus)
Kulovitý, silně světlolomný útvar, sestavený ze zrn
podobných ribozomům. Řetězovitě spojení zrn ve vláknitou hmotu - nukleolonema.
Prostor je vyplněn řidší (pars amorpha) hmotou. Povrch bez membrány.
Převažují RNK a bílkoviny (histony a globuliny), z
tuků se vyskytují fosfatidy.
Funkce: tvorba r-RNK, potřebné k syntéze bílkovin
v podobě robozomů, účastní se regulace buněčného dělení. V době dělení
buňky na některých chromozomech tzv.organizátory jadérka, jinak mizí.
Počet jadérek - 1-2, někdy více. V oocytech
obojživelníků stovky jadérek. Podle metabolické aktivity buněk lze rozlišit i
několik typů jadérek (vytváří se v nich materiál na ribozómy, související s
proteosyntézou).
Uložení - uprostřed jádra nebo u jaderné membrány,
velikost asi 1 mm.

Vyvíjející se žabí oocyt (nahoře) má
světle zbarvené jádro a mnoho jadérek. Zralý oocyt má jádro klidové, dobře
barvitelné a jadérka redukovaná. VP
1.5.4. Mitochondrie (URL 83)
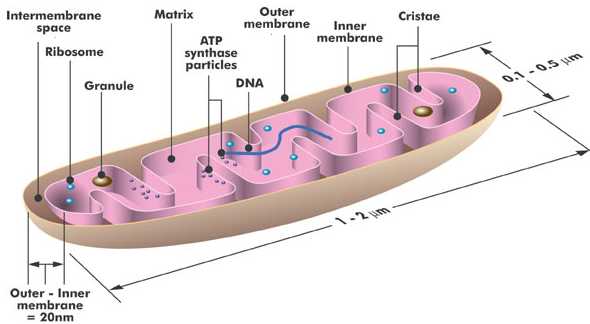 (převzato z URL 84)
(převzato z URL 84)
Zrnité, oválné, vláknité útvary, velikost 0,5 x 7
μm.
V cytoplazmě 50-5000. Velmi důležité organoidy. Dvojvrstevné
lipoproteinové pouzdro. Vnitřní stěna se vychlipuje do tzv. cristae
mitochondriales - neúplné přepážky nebo tubuly. (Údajně
jsou typické pro organismus, avšak u člověka mají mtch. produkující steroidní
hormony místo krist protáhlé tubuly, což svědří to tom, že organismus je
schopen mitochondrie ovlivňovat.)
Vnitřní prostor (matrix) - základní hmota, v ní někdy
mitochondriální tělíska - podobná ribozómům.
Zjištěné látky: bílkoviny enzymatické povahy (65-70%
sušiny)
lipidy (25-30% sušiny)
NK (3% sušiny)
vitaminy
ADP, ATP
glycidy
anorg. kationty K+, Fe2- aj.
Funkce - probíhá v nich oxidativní fosforylace -
štěpení cukrů až na CO2 a H2O, též štěpení tuků a také aminokyselin.
Továrny na energii, kterou váží do ATP.
ADP + H2PO4 + 12.000 cal/mol = ATP + H2O a zpět
Vnější membrána - volně propustná pro ionty,
aminokyseliny, cholesterol + fosfolipidy, ADP, ATP, sacharózu.
Vnitřní membrána je propustná jen selektivním
transportem – obsahuje více bílkovin + kardiolipin.
Uvnitř vnitřní membrány se nacházejí tzv.oxizómy:
tělíska s enzymy dovolující transport elektronů (cytochromoxidáza aj.). Na
membráně se nacházejí tzv.elementární tělíska tvaru malých houbiček. Jde o
enzymy umožňující transport protonů a syntézu ATP. Působením protonových pump
vzniká na vnitřní membráně protonový gradient jehož vyrovnáním se aktivuje
dýchací řetězec. Ten je umožněn již zmíněnými enzymy (cytochromy), které umožní
vazbu P do makroergických fosfátových vazeb (ATP). (Komplexní reakce se účastní
vnitřní membrána i povrch matrix.)
Matrix -vnitřní vrstvy - biosyntetické reakce.
Vnější membrána - syntéza i odbourávání fosfolipidů,
metabolismus tuků.
Možná existuje i vztah mitochondrií
k metabolismu vody.
Součet MTCH = centrum dýchacích pochodů buňky.
Množení mitochondrií: pučení, životnost několik dnů.
Genetický systém MTCH: DNK, RNK, mitoch. tělíska
(ribozómy), semiautonomní organoidy. Dědění mitochondrií: po mateřské linii
pohlavních buňek.
1.5.5. Endoplazmatické retikulum (ergastoplazma)
Soustava kanálků a dutých lamel prostupujících hustě
základní cytoplazmu.
Stěny - jednotková membrána, 5 nm. Povrch někdy
pokryt drobnými ribozómy, jindy hladký - hladké a drsné ER.

Hladké a drsné endoplazmatické retikulum (URL 92)
Funkce
- syntéza bílkovin, tuků, glykogenu. V drsném ER
bílkoviny, v hladkém tuky a glykogen.
- vnitrobuněčný transport napojení na povrch buňky i
na jadernou membránu.
- cisterny pro Ca2+ ionty ve svalových
vláknech (hladké ER).
Složení - lipoproteinová membrána +RNK + enzymy.
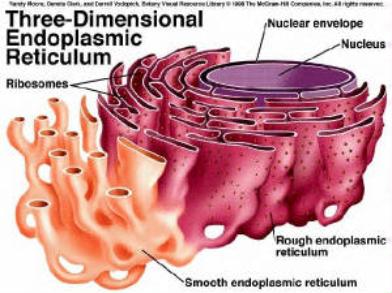
Trojrozměrné schéma
endoplazmatického retikula (převzato z URL
194)
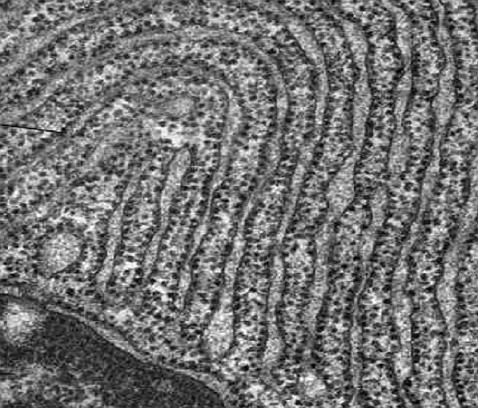
Drsné EPR - membrány s ribozómy – syntéza proteinů (dole jádro
s karyotékou)
1.5.6. Ribozómy
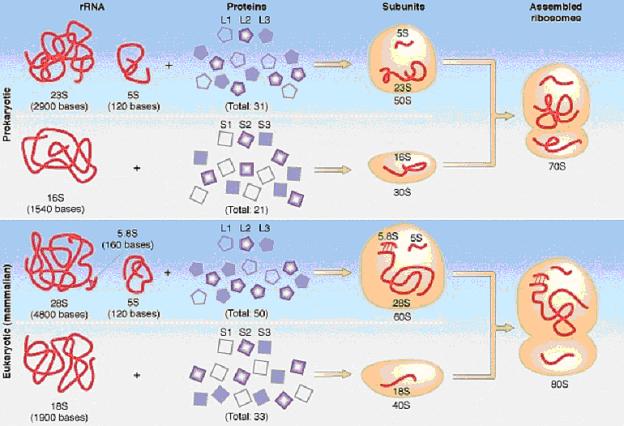
Ribozómy jsou komplexy složené
z bílkovin a rRNA. U různých druhů se poněkud liší.
Největší rozdíl je mezi prokaryoty a
eukaryoty a to v e velikosti molekul RNK a množství proteinů, které se
s nimi spojí do komplexů. (URL 85)
Velikost u
eukaryotických buněk je 15-25 nm, tvořeny převážně RNK a proteiny
(poprvé popsány Paladem, proto též Paladeho tělíska).
Nacházejí se na povrchu ER jednotlivě nebo
v cytoplasmě v tzv. polyzómech
(vícero RZ spojeno jednou i-RNK). Vznikají v jadérku, což je
v podstatě shluk r-RNK, která se přepsala na určitých úsecích DNK, kde je
uložena právě k tomu potřebná niformace. Proteiny odpovědné za přepis r-RNK
jsou na chromozómech uložené jako tzv. organizotory jadérka.
Složení - 2 různě velké podjednotky oddělené rýhou a
poutané atomy Mg. Při syntéze bílkovin se ribozómy napojí na m-RNK a
vzniká již zmíněný polyzóm.
1.5.7 Cytocentrum,
(centrozóm, periplast)
Jde o shluky gama-tubulinu a dalších bílkovin, které
umožňují formaci mikrotubulů dělícího vřetenka (MTOC – mikrotubuly organizující
centrum). V živočišných buňkách je uvnitř tzv. centriola, dělící tělísko,
tvořené 9 trojicemi mikrotubulů a asociovanými bílkovinami. Počet centriol je
údajně shodný s ploiditou buněk. U diploidních, jsou dvě centrioly na sebe
kolmé (obrázek). Zřetelné je i v
klidové fázi - poblíž jádra, u některých prvoků i uvnitř jádra. Popsáno
Vejdovským 1886.
Převzato z URL 78
Pod elektronovým mikroskopem:
1 nebo 2 centrioly - stěny z krátkých trubiček - 9
trojic mikrotubulů. Někdy na vnější straně tzv. satelity. Jsou-li 2 centrioly,
jsou kolmé navzájem. Kolem centriol vakuolizovaná centroplazma, ze které
vybíhají vlákna gelizované plazmy – astrosféra. Podle nových poznatků jde o
plášť z γ – tubulinu, tzv. mikrotubuly organizující centrum.
Funkce – při buněčném dělení a tvorbě dělícího
vřeténka, ačkoli se dnes tato úloha popírá. Stejnou strukturu mají i tzv,
bazální tělíska bičíků a brv, která strukturu kmitajících organel zakotvují.
Struktura dělícího nebo bazálního
tělíska. C,B,A – označení jednotlivých mirotubulů v trojicích.
1.5.8. Lysozómy (0,25-0,8 μm) (URL 86)
Objeveny v roce 1955. Prokázány ve většině buněk,
hojné např. v bílých krvinkách.
Tvar - kulovité částečky, průměr asi 400 nm, povrch
kryt lipoproteinovou membránou, uvnitř zrnitá nebo kompaktní hmota -
hydrolytické enzymy (nukleázy. amylázy a proteázy ve formě proenzymů), které
hydrolyzují (rozkládají) látky přicházející do buněk pinocytózou nebo
fagocytózou. Vzniká tak multivezikulární tělísko nebo, splyne-li
s lysozómem fagozóm vzniká
digestivní vakuola či sekundární lysozóm. Následuje okyselení vnitřního
prostředí transportem protonů dovnitř (protonové pumpy v membráně) a
aktivace enzymů (které by jinak zlikvidovaly biomembránu primárního lysozómu),
pak difúze produktů do cytoplazmy) - reziduální tělísko – exocytóza nebo
hromadění v buňce. Tráví vše kromě tuků.
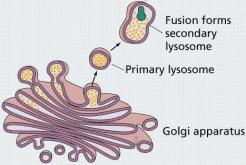

Lysozómy (URL 92)
V době hladu buňky - částečná autolýza cytoplazmy, energie z vlastního těla.
Umírání buňky - vylijí se všechny lysozómy,
zkapalnění obsahu, úplná autolýza - rychlé odstranění odumřelých buněk z tkání.
Infarkt myokardu – vylití lysozómů v důsledku nedostatku kyslíku. Apoptóza
– programovaná smrt buňky, též s účastí lysozómů.
Nové lysozómy se tvoří v Golgiho komplexu (a ER,
jestliže Golgiho komplex není).
Proteazómy (URL 172, URL 174, 6)
–komplex enzymů pro nelysozomální degradaci většiny proteinů nacházejících se
uvnitř buňky. Tento proces začíná vazbou několika molekul malého globulárního
proteinu ubikvitinu (URL
173) na molekulu proteinu určeného k degradaci.
1.5.9. Golgiho síť (Golgiho aparát, endopegma, GA), diktiozóm
 (URL 186)
(URL 186)
Na preparátech stříbřených nervových tkání pozoroval
Golgi 1898 sítě poblíž jader nervových buněk. Později byly nalezeny i v jiných
buňkách a označeny jako Golgiho komplex.
Podobná se
endoplazmatickému retikulu - shluky k sobě přiložených plochých cisteren a
je obklopujících vaků a váčků.
Spojení s endoplazmatickou sítí, jádrem, povrchem
buňky (pravděpodobně přes váčky). Stěny tvoří membránová jednotka , asi 7,2 nm.
Funkce - shromažďuje a dále zpracovává produkty ER -
tuky, hormony, enzymy, cukry a jiné produkty odškrcuje v podobně
membránových váčků různého typu:
- hydrolytické enzymy jako tzv. lysozómy
- tvoří sekreční váčky buněk určené pro vnější
využití (regulovaná a neregulovaná sekrece, sekreční dráha - od transkribce
v jádře do exocytózy sekretu – výměsky žláz a tvorba mezibuněčných hmot).
vylučuje přebytky H2O a odpadní látky.
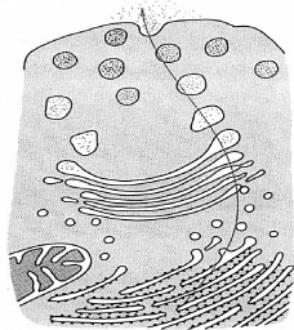
Schéma
sekreční dráhy v buňce – informace přepsaná v jádře se přečte na
dreném EPR a přeloží do sekvence aminokyselin púotřebného proteinu. Ten se
dostává do Golgiho komplexu (cis cisterny), kde dochází k jeho úpravě až
konečně diktiozómu nejvzdálenějším od jádra (trans) se odětěpí jako membránový
sekreční váček. Neregulovaná sekrece – stálé vylučování (sliny), regulovaná –
na pokyn signálu (hormon, nervový impulz… trávící enzymy)
V případě,
že se dostane do lysozómu, zůstává produkt v buňce
EM snímek
sekreční buňky pankreatu. Drsné EPR (nahoře), světlý GA uprostřed, tmavé
sekreční váčky (Z dole). Vpravo uprostřed mitochondrie (M).
(Klika a
kol. 1986)
1.5.10. Mikrotělíska:
Peroxizómy s peroxidázami a katalázemi
(membrány)
+ glyoxizómy (rost.), glyoxalátový cyklus - olejnatá
semena, klíčení,
+ hydrogenózy - anaerobní životní podmínky
-bičíkovci.
1.5.11. Cytoskelet
Síť trubicovitých a vláknitých útvarů umožňujících
pohyb a zpevňujících buňku, podílí se na mezibuněškých spojích: mikrofilamenta,
mikrotubuly, intermediární fiolamenta.
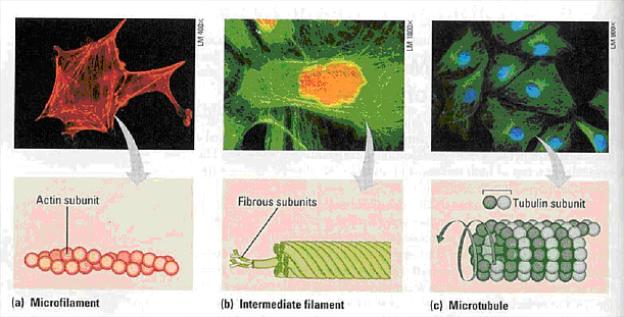
Ukázka tří
základních typů cytoskeletu. Nahoře snímky z fluoresenční mikroskopie
ukazují hustotu jednotlivých typů v buňce. (Fibrous subunit – vláknitá
podjednotka.)
Mikrofilamenta (5 - 6 nm)
- slouží k pohybu buňky nebo váčků
a struktur uvnitř buňky Jsou dva základní typy MF:
-
-
aktin – F a G a k němu se vážící
troponin, tropomyosin, filamin
-
-
myosin, myosinové vlákno.
Podíllejí se na pohybu cytoplasmy (amoeboidní pohyb,
tvorba kortexu, přesun měchýřků) a pohybu svalovém (aktinomyosinové komplexy).
(Tvoří též tzv. spasmonemata – smrštitelná vlákénka - prvoků vířenek).
Aktin je
jednolomný.
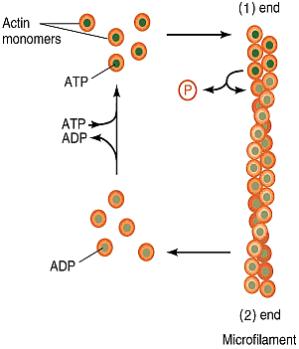
Aktin , na jednom konci kondenzuje
z globulárních podjednotek (G - actin) za spotřeby ATP, iontů K a Mg
a na druhém konci může depolymerovat, rozpadat se. Vzniklá vláknitá konfigurace
se stáčí do šroubovice s dalším vláknem a vzniká tak vláknitý F – actin.
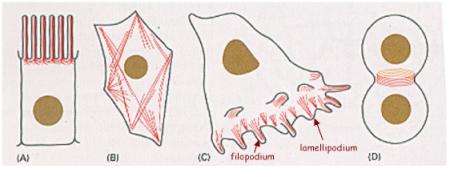
Přítomnost aktinových vláken v buňkách:
-
-
v mikroklcích enterocytů
-
-
v buňkách hladké svaloviny
-
-
v buňkách schopných tvořit panožky
(pseudopodie)
-
-
v dělících se buňkách při
zaškrcování cytoplazmy
Myozin je
dvoulomný.
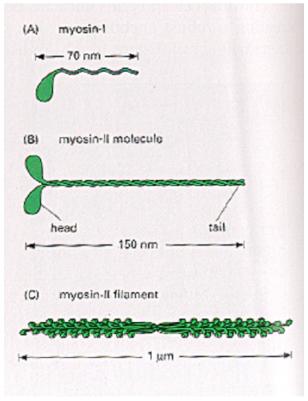
Myozin se vyskytuje ve dvou formách:
myozin-1 – kratší vlákno s jednou hlavičkou
(místo ATPásové aktivity).
myozin-2 – dvě a více molekul stočených dohromady,
tvořících i robustní vlákna tzv. meromyozinu – těžkého myozinu.
V myozin je schopen vázat se na aktin a současně
měnit prostorovou konfiguraci části své molekuly (hlavičky) tvoří tak struktury
schopné měnit polohu – pohybovat se. Animaci pohybu myozinu V po vláknu
aktinu najdete zde
. (http://www.fbs.leeds.ac.uk/research/contractility/myosinv/index.htm)
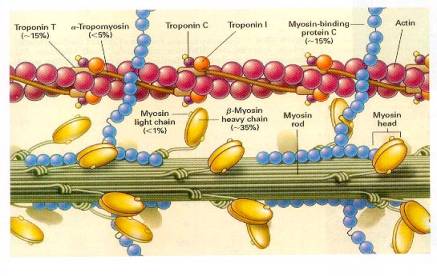
Interakce
aktinu a myozinu. Převzato z http://www.edcenter.sdsu.edu/cso/paper.html
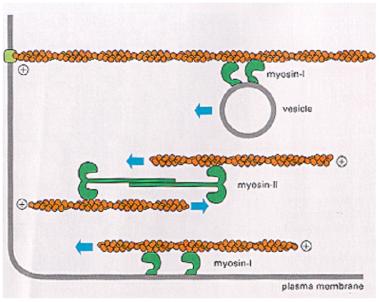
Různé způsoby pohybu pomocí mikrofilament:
Nahoře -
myozin-1 nese po aktinovém vláknu membránový váček
uprostřed – pomocí myozinu-2 se pohybují dvě aktinová
vlákna proti sobě
dole – myozin-1 vázaný na cytoplazmatickou membránu
pohybuje vláknem aktinu.
Mikrotubuly
jsou u všech buněk - trubičky o průměru 20-30 nm.
Délka různá (až stovky μm), účastní se tvorby bičíků, brv, cytoskeletu,
dělícího vřeténka.
Proměnlivost během života buňky (též vliv tlaku,
teploty, kolchicinu).
Stavba: gelovitý stav glomerulárních molekul alfa a
beta tubulínů, tvořících dimér.
13 dimérů vytváří jednotkové subfibrilu, 13 (ale i
méně) subfibril tvoří 1 mikrotubulus. Uvnitř subfibrily - disulfidické vazby,
mezi subfibrilami - vodíkové můstky. Kondenzace (za přítomnosti GTP na
podjednotkách) na tzv. + konci dekondenzace na –konci za spotřeby GTP a
uvolňování GDP.
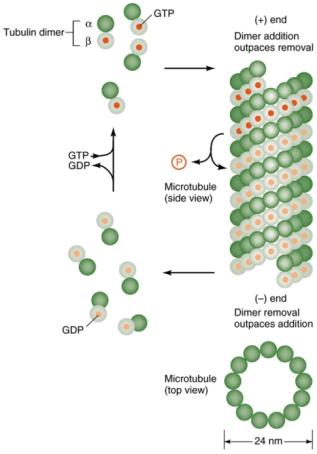
Princip
kondenzace mikrotubulů a jejich
struktura.
Při tvorbě dělícího vřeténka se vytváří tzv.
centrozóm, neboli mikrotubuly organizující centrum (MTOC), kde se hojně nachází
tzv. γ – tubulin. MTOC bývá kolem centriolu, jenž však k dělení buňky
údajně není nutný. (U diploidních buněk jsou centrioly dva, kolmo k sobě,
u haploidních jeden, u polyploidních více, podle ploidie.)
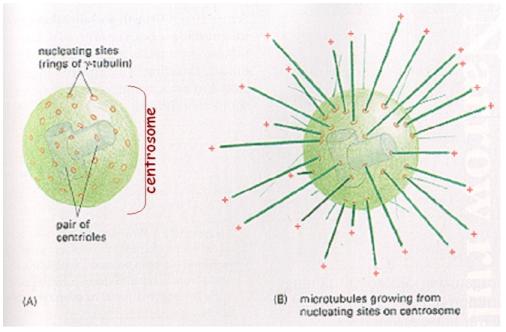
MTOC kolem centriol. Převzato
z www. Podrobnější obrázek viz URL
220
Mikrotubuly také tvoří kostru brv a bičíků. Dva
centrální MT jsou obklopeny strukturou z 9 dvojic MT a vše je propojeno
asociovanými proteiny. Z nich dynein, tvořící specifická raménka, může za
spotřeby energie po sousedním MT šplhat a tím měnit tvar bičíku, což se odrazí
v jeho ohybu a tím i pohybu. Pohyb není rotační, jen krouživy nebo vlnivý.
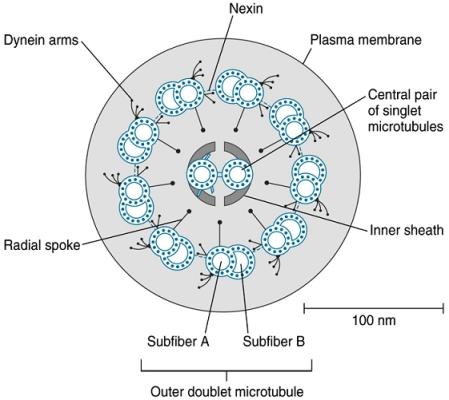
Schema struktury bičíku rozříznutého
příčně. Nexin a radiální tyčka (spoke), stejně jako vnitřní pochva (sheath)
jsou strukturotvorné bílkoviny
Navíc mohou MT sloužit jako dráhy pro pohyb menších
buněčných struktur (váčků). Ty jsou navázány na dynein nebo kinezin,
které se za spotřeby energie moho po MT pohybovat a tím nést váček na jiné
místo v buňce. (Dynein klouže k -konci a kinezin k +konci MT).
Tímto způsobem se také po kinetochorových MT pohybují chromozómy při dělení
buněk.
Intermediární
filamenta (URL
188) (intermediate filaments) - tonofibrily epiteliálních buněk,
buněk chordy dorsalis, buněk gliových - stálé, cytoskelet v pravém slova
smyslu. Jde o různé proteiny podle typu živočišné buňky. Základní molekuly vždy
fibrilární (mikrofilamenta aktin a tubulin jsou globulární). Jde např o
cytokeratiny, vimentin, desmin, neurofilamentární protein, gliový protein,
nestin, internestin, integriny, kadheriny aj.
Funkce :
-
-
podpůrná ( mezibuněčné spoje a připojení
buněk k podloží - desmozómy epiteliálních buněk, fokální kontakty)
-
-
pohybová (ve svalových buňkách), avšak
nepřímo, tvoří oporu pro strukturu myofibrily
-
-
někdy obě funkce současně
-
-
v jádře již vzpomenuté laminy
Patří sem i vlákna v mezibuněčné hmotě - kolagen,
elastin, retikulin, někdy i v buňkách pojivových.
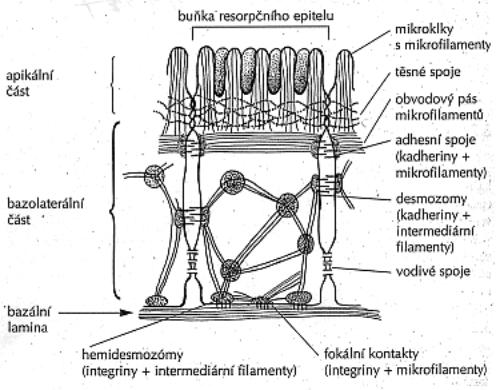
Příklad
účasti mikrofilament a intermediálních filament na cytoskeletu buňky a její pevné nebo volné fixaci
k prostředí. Mikrofilamenta uvnitř mikroklků umožňují transport
resorbčních váčků skrz cytoplasmu. Shora jsou buňky spojeny tzv. těsnými spoji
(tight junctions) pomocí proteinů v cytoplazmatické membráně (částečné
splynutí sousedních membrán – pás kolem buňky – zonula ocludens). Tím je buňka
oddělena v tomto případě od prostředí střeva. Následuje oblast tzv. adhesivních
spojů (zonula adherens – pás kolem buňky), kde na transmembránové proteiny
kadheriny (propojující dvě buňky) jsou zevnitř vázána mikrofilamenta. Tím je
umožněn částečný pohyb této oblasti. Dalším typem spojů jsou tzv. dezmozómy
(macula adherens), kde na transmembránové kadheriny vzájemně vázané se napojují
intermediární filamenta - vlastní cytoskelet buňky. Tím je držena struktura
buňky. Směrem k bázi buňky mohou
tvořit transmembránové proteiny integriny tzv. hemidezmozómy, jsou-li na ně
v buňce vázána intermediární filamenta (fixace buňky) nebo naopak tzv.
fokální kontakty, jsou-li napojeny na mikrofilamenta. V tomto případě se
buňka může pohybovat po substrátu. Buňky mohou také tvořit vodivé spoje, tzv.
nexy, kdy transmembránové proteiny konexiny vytvoří otvůrky pro cytoplasmatické
spojky. Viz též URL
189. Funkce spojovacích transmembránových proteinů je mimo jiné ovlivňována
např. ionty vápníku.
The eukaryotic cytoskeleton. Actin filaments are shown in
red, microtubules in green, and the nuclei are in blue.
Převzato z URL 216
Intermediární
filamenta v buňkách (převzato z URL
187)
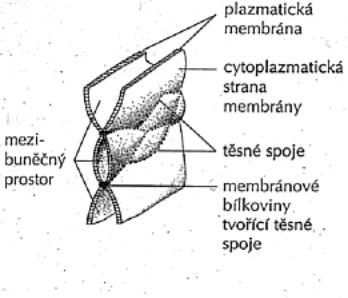
Příklad těsných spojů tvořených
transmembránovými proteiny
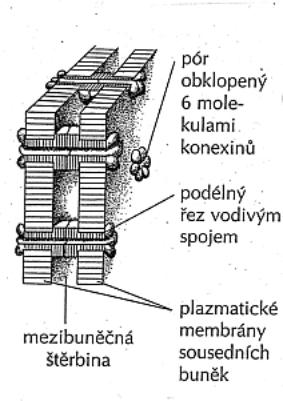
Příklad vodivých spojů, tvořených
transmembránovými proteiny, tzv. konexiny
1.5.12.
1.5.12. Buněčné inkluze (metaplazma)
Kapénkovité
nebo krystalické struktury v základní cytoplazmě, složené buď - z rezervních
látek (glykogen, tuky, bílkoviny) nebo - z látek odpadních (pigmenty, minerální
soli).
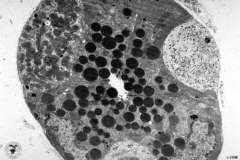 Granule obsahující produkty určené
k sekreci. Žlázová buňka v žaludku. Převzato z www.
Granule obsahující produkty určené
k sekreci. Žlázová buňka v žaludku. Převzato z www.
Někdy silné nahromadění metaplazmy - tukové buňky.
Tukové buňky zcela naplněné tukem.
Jádra tmavá. Cytoplasma zatlačená k okrajům buněk. VP
Červeně zbarvená zrna glykogečnu
v jaterních buňkách. Jádra jsou modrá. VP
Melaniny - hustě nahloučená oválná zrna, vznik v
Golgiho aparátu, dávají vznik melanozómům.
(URL
89) Disperze či agregace melanosomů, váčklů naplněných melaninem, ve
specializovaných buňkách ryb a obojživelníků způsobuje změnu barvy pokožky,
důležitou pro kamufláž nebo sociální interakce. Kinesin II odpovídá za
transport na větší vzdálenosti pomocí mikrotubulů (zelené), zatímco myosin
V na aktinových filamentech (červeně) je nezbytný pro stejnoměrné
rozložení melanosomů v buňce.

Pohled na pigmentovou buňku
mezenteria skokana (Rana sp.) Zrna melaninu jsou částečně zřetelná. VP
Hemosideriny (URL
88) - rezervy železa (ferritin) :
-
-
4 stmelená zrna (siderozóm) - makrofágové po likvidaci červených krvinek
(rozklad hemoglobinu)
Tekuté inkluze - ve váčcích ohraničených jednotkovou
membránou (vakuoly) se vyskytují u rostlinných buněk. Zde se často vyskytují i
inkluze pevné, krystalické.
Vakuola (URL 92).

Krystalické inkluze v rostlinných buňkách (URL 87):
Nahoře: šťavelan vápenatý v listech oleandru
Uprostřed: šťavelan vápenatý v kořenech vanilky
Dole: částice křemičitanu v pokožce Schizachyrium
sanguineum
1.5.13. Peroxizómy
Jsou nutné k přeměně aminokyselin a tuků na cukry
(glukoneogenéza) - játra a ledviny savců. Podobají se lysozómům - váčky
velikosti asi 500 nm obdané jednotkovou membránou. Uvnitř enzymy - oxidázy. Neobsahují
hydrolázy. Vznikají asi v ER.
 Peroxizóm (URL 92)
Peroxizóm (URL 92)
(Glyoxizómy, urikozómy, hydrogenozómy a j.)
2. CYTOLOGIE II (rozmnožování buněk)
Dělení buněk (URL 98)
umožňuje růst a vývoj mnohobuněčných organismů.
Typy dělení: pučení (kvasinky někteří
prvoci)
1 - přímé - amitóza
2 - nepřímé - mitóza
3 - (redukční) - dozrávajících pohlavních buněk
2.1. Amitóza: jádro zůstává zachováno, piškotovitě se zaškrtí a
rozdělí na dvě jádra dceřinná. Následně probíhá dělení ostatní buňky. Jde o
a) degenerativní dělení starých buněk,
d) d) nebo u buněk vysoce specializovaných,
e) e) Často předchází amitóza fragmentaci jádra (rozpadu) - vícejaderné
buňky, které později zanikají.
Pseudoamitóza - jádro zevně zachováno, ale v nitru dochází k modifikované mitóze.
Dceřinné buňky ať jedno- nebo vícejaderné mají schopnost stále se dělit – tento
typ dělení patří k mitóze.
2.2. Mitóza (URL 93) Zvaná též jako dělení nepřímé je normální
dělení tělních, somatických buněk. Toto dělení je součástí tzv. buněčného
cyklu, který charakterizuje život buňky a sestává z mitózy a tzv.
interfáze, doby do další mitózy. Mitotickým dělením se zaručuje, že do
dceřinných buněk se za normálních okolností dostane správné množství genetické
informace, uložené v molekulách DNK, které pro potřeby mitotického dělení
kondenzují za pomocí bílkovin do tzv. chromozómů. Mitotické dělení začíná tzv.
karyokinezí, rozdělením jádra, na které pak navazuje cytokineze, rozdělení
cytoplazmy.
2.2.1.
Chromozómy
Pentlicovité útvary vyskytující se v buňce během
karyokineze. Jejich velikost je 0,2- 25 nm, mají různý tvar a počet (až dvě
sta).
Při tvorbě chromozómů se DNK spolu s proteiny
zv. histony (URL
168) stáčí v tzv. nukleozomy, vlákno nukleozómu spiralizuje a tvoří
tzv. solenoid (NK + histony). Po několika úrovních dalšího sřasení pomocí
proteinů nehistonového typu vzniká útvar zvaný chromatida. Pokud správně prošel
interfází, má každý chromozom dvě chromatidy. Jde o identické kopie DNK, která
byla v interfázi zdvojena. Chromatidy jsou spojeny v místě zvaném
primární zúžení (konstrikce), kde se nachází proteinový systém zvaný
centroméra, jenž umožňuje rozdělení chromatid v pravý čas a připojení
mikrotubulu dělícího vřeténka v místě zvaném kinetochór.
Podle umístění centroméry (URL
107) rozeznáváme chromozómy
-
-
akrocentrické: centomera leží velmi
blízko jednoho z konců
-
-
submetacentrické: centromera leží mezi
středem a koncem chromozómu
-
-
metacentrické: centromera leží velmi
blízko středu chromozómu
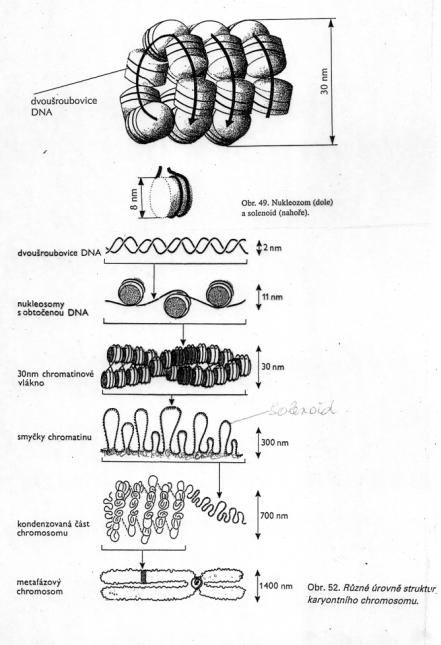
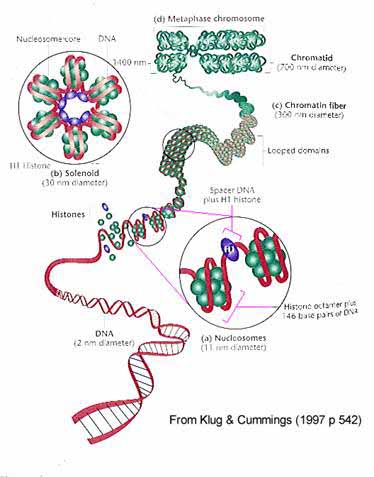
Na obou obrázcích je znázorněno
řasení DNK v chromozómy.
2.2.2. Mitóza - vlastní průběh
Jak již bylo uvedeno, lze při mitóze lze rozlišit dvě
hlavní fáze -
karyokinéze
- dělení jádra
cytokinéze
- dělení plazmy
2.2.2.1. KARYOKINÉZE (Strassburger 1884): profáze, metafáze, anafáze a
telofáze.
I.
I.
Profáze:
1)
1) Rozdělení centriolu, putování dceřinných k pólu buňky
2)
2) Zánik jadérek
3)
3) Tvorba chromozómů - zpočátku tenkých spiralizovaných vláken pospojovaných v oblasti
centroméry - překřižují se či řetězovitě seřazují, vzniká spirém -
dlouhá chromatinová pentlice. Další spiralizace, zkracování
(až 25 x) a nakonec rozštěpení chromozómu na 2 chromatidy. Vzniká
tzv. ekvační štěrbina. Chromatidy jsou nadále spojeny jen centromerami.
4)
4) Vytvořena dělící vřeténka z mikrotubulů (MT-
polární, kinetochorové, vřeténkové. Vazba na konetochor na centromeře, kde
je rovněž dynein.Rozpad jaderné
membrány vzniká tzv. mixoplazmy
Achromatický aparát
- vláknitá siť astrosféry dělícího vřeténka centrioly
sloužící jako opora v průběhu mitózy. Špatně se barvící hmoty. (MTOC.)
Profáze uprostřed,
vpravo řada interfázních jader, kořen cibule (1000 x)
II. Metafáze:
Seskupení chromozómů do tzv. ekvatoriální roviny buňky, kde se orientují
centromerami ke středu této roviny. Pohyb chromozómů – metakinéze (je
udajně umožněn kinetochorovými mikrotubuly) vzniká metafázní destička (též
ekvatoriální). Prostřednictvím kinetochórů se chromozómy napojí na
vlákna dělícího vřeténka. Monaster –jedna hvězda.
Metafáze dole, nahoře interfázní bňky s dvěma
jadérky (vpravo jedno odříznuto)
III. Anafáze:
Dělí se centromery a kinetochory, tím se chromozómy rozštěpí docela. Počet
chromozomů se zdvojnásobí. Ekvační štěrbina se zvětšuje, nastává anafázní
rozestup chromozomů, které se po vláknech dělícího vřeténka posunují k
opačným pólům buňky. Do každé poloviny jde vždy 1 sesterský chromozóm - diaster.
(Nově: vřeténkové MT klouzavě odtlačují obě poloviny systému k pólům.)
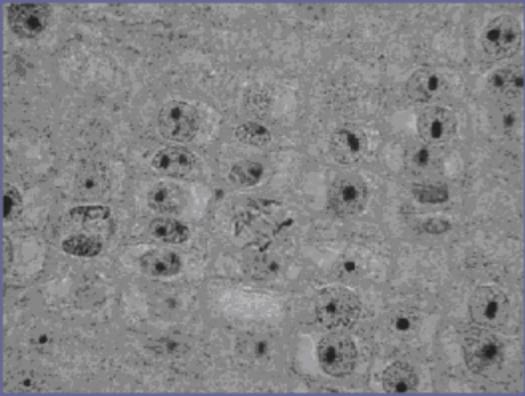
Anafáze -
přibližně uprodtřed, vlevo telofáze, ostatní buňky většinou v interfázi
IV. Telofáze:
Chromozómy jsou soustředěny na pólech buňky, centromérami orientovány k
centriolům. Dále dochází k jejich prodlužování, despiralizací až k
postupnému rozpadu. Současně vznikají jadérka z chromocentra (organizátory
jadérka). Dělící vřeténko mizí, stejně i astrosféra. Nakonec se
kolem každé skupiny vytváří jaderná membrána. (Telofázní rekonstrukce
jader).
Výsledkem:
jsou dvě dceřinná jádra se stejnou kvalitou i počtem chromozómů jako bylo v
jádře mateřské buňky. Množství hmoty jader = poloviční.
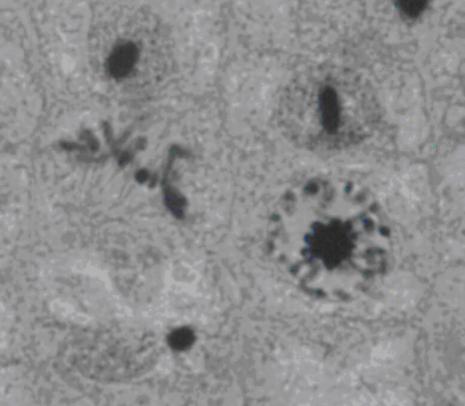
Vlevo metafáze, vpravo profáze v řezu, formující
se chromozómy vázány na karyoskeletu, jadérko dosud zachováno
2.2.2.2. Cytokinéze: V
průběhu mitózy dojde:
a) ke ztrátě povrchových organel (bičíků, řasinek),
zakulacení buňky,
b) zneklidnění povrchové vrstvy cytoplazmy,
c) rozpad fibrilárních struktur
(a) až c) = malé nenápadné změny).
Teprve při anafázním rozestupu chromozómů
dochází k fontánovitému proudění cytoplazmy, rozdělení organoidů do dceřinných
buněk, vytváření rýhy na obvodu a od ní ke středu buňky se tvoří přepážka
centripetálně (dostředivě). U vajíček hmyzu a rostlinných buněk – centrifugálně
(odstředivě). Mezi oběma buňkami se vytvoří vrstvička hyaloplazmy, která na
obě strany vytváří cytoplazmatickou membránu (popřípadě i morfologickou
membránu).
2.2.2.3. Ploidie
Celkový počet chromozómů v buňce se označuje jako chromozomální
sada.
Chromozomální sada obsahuje chromozómy homologní
tvarově stejné (autosomy) a chromozomy heterologní - morfologicky
odlišné (gonosomy). Chromozómy v mitotické fázi, obarvené a seřazené podle
velikosti a tvaru se označují za karyotyp. Sada, obsahující po jediném
zástupci každého chromozómu, seřazená podle velikosti, se nazývá idiogram ( viz
např. URL 105).
Somatické buňky obsahují běžně dvojitou chromozómovou
sadu (původem od otce i matky), jsou v tzv. diploidním stavu. Gamety
(pohlavní buňky) nebo někteří jedinci vzniklí partenogeneticky mají
v buňkách poloviční – haploidní počet chromozómů (trubec včely). Znásobený
počet chromozomálních sad se označuje za polyploidii.
Polyploidní bývají většinou rostliny, u živočichů
buňky některých specializovaných tkání.
Odchylky
od normálu:
MIXOPLOIDIE
- chromozomová mozaika - v těle jednoho živočicha jsou buňky o různé ploiditě
(larvální tkáně včely, děložní sliznice savců, nádorové tkáně)
ANEUPLOIDIE
- Znásobeny jsou jen některé chromozómy
AUTOPOLYPLOIDIE - působením vnějších faktorů (teplota, chemické látky) dojde
k znásobení chromozómových sad.
ALLOPOLYPLOIDIE - důsledek křížení různých druhů = HYBRIDIZACE
2.3. MODIFIKACE MITÓZY (URL
90)
Mimo karyoblastické prostředky dochází někdy k
odchylnému průběhu mitózy vlivem vnitřních faktorů - název modifikace mitózy.
1) ENDOMITÓZA: je to vlastně zkrácená karyokinéze.
V některých tkáních se nacházejí buňky s velkými jádry - 2,3 i n krát větší
hmota než u jader nejmenších. Jde o modifikovanou profázi, kde uvnitř jádra
dojde k tvorbě, zkrácení i rozdělení chromozómů, ale nenavazuje jejich rozestup
a jádro se nedělí. Chromozómy opět despiralizují a mizí a jádro se zvětšeným
počtem chromozómů přechází do klidové fáze - větší objem jádra - zvětšení
cytoplazmy podle N poměru.
P Tkáně zatížené ve své funkci - znásobují
intenzitu funkce v kratší době.
Polyploidní x n buňky : dělí se mitózou - polyploidizace se
zachovává
somatickou redukcí - se počet chromozómů upraví na 2n.
Někdy nedochází v jádře vůbec k viditelným změnám -
chromozómy se asi dělí v despiralizovaném stavu.
2) POLYTENIE - modifikace mitózy umožnující zvýšení
funkce, avšak
nevede k polyploidizaci. DNK syntetizovaná v S fázi se v podobě vláken
ukládá v tzv. obřích polytenních chromozómech. V každé syntetické
periodě se zdvojnásobí počet chromonem i chromomer, ale nedochází k
rozdělení do chromatid. Chromozómy se nedělí ale zůstávají spojeny i 2
homologní spolu = konjugovány.
Terčíky - agregace chromomer. Čárkový kód je jiný u heterologních
chromozómů a u různých živočišných druhů.
Balbioniho prstence - chromozómové protuberance,
puffs - oblasti bez terčíků s despiralizovaným vláknem nukleotistonů.
Přítomna i m-RNK a jiné bílkoviny. Roste objem jádra i celé buňky, která
znásobuje po každé S-fázi svou výkonnost.
Zpětná úprava - somatická redukce.
Polytenní chromozómy obsahující tzv.exony
(úseky DNK, které buňka přepisuje) v makronukleu slávinky (Stylonychia
sp.)
Polytenní chromozómy pakomára
(Chironomus sp.)ve slinných žlázách. Šedivá masa kolem chromozómů přibližně
uprostřed snímku je místo, kde se přepisuje r.RNK (organizátor jadérka).
V levém rohu dole pro srovnání tytéž chromozómy v metafázi
v diploidním stavu
3) SOMATICKÁ REDUKCE - Buňka vstupuje do
mitózy bez toho, že by proběhla syntetická perioda - navádí se normální poměry
v buňkách s polytenními nebo polyploidními chromozómy.
4) RESTITUČNÍ DÉLENÍ JÁDRA - Na metafázi
mitózy navazuje rekonstrukce jediného jádra, počet chromozómů se
zdvojnásobí (vaječné buňky partenogeneticky se vyvíjející) - upravuje se haploidní
stav neoplozeného vajíčka na stav diploidní.
5) PROMITÓZA (PSEUDOMITÓZA) - Normální mitóza
s tím, že všechny karyokinetické fáze se odehrávají uvnitř jádra. Cytocentrum,
uvnitř jádra nebo mimo ně, někdy chybí. Karyokinéze se projevuje zaškrcením
jádra, piškovitým protažením a nakonec rozdělením. Podobné jako u amitózy.
Promitóza zjištěna u některých prvoků, je považována za fylogeneticky
předstupeň mitózy. Sem patří zřejmě i dělení makronukleů u prvoků (polyploidní
jádra), kde předtím nastalo rozmnožení jaderné hmoty.
6) VZNIK PLAZMODIÍ (mnohojaderných buněk)
Opakovanou karyokinezí uvnitř jediného, ale
rostoucího buněčného těla. Někdy se takové mnohojaderné buňky mohou rozdělit na
jednojaderné. (Možnost existence multipolárního dělícího aparátu u endomitózou
narostlých jader a buněk).
Multipolární mitóza - rekonstrukce několika i desítek jader současně a následný rozpad
buňky na stejný počet dceřinných.
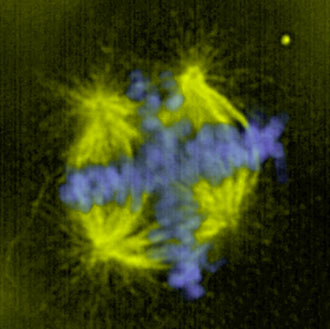
Převzato
z URL
104
Apiconyplexa
- nebo nesomální stav po polyspermii - oplození vaj. buňky více spermiemi.
2.4. OVLIVNĚNÍ MITÓZY
- Mitotické jedy - látky narušující normální průběh
mitózy
a) Antefázní jedy (antefáze = syntetická
perioda DNK) -
postihují syntézu DNK a tak znemožňují nástup mitózy
(purinové a pyrimidinové látky, yperit, rtg záření).
b) Chromozomální jedy - chemické látky
reagující s NK tvořících se chromozómů - poruchy v seskupování a štěpení
chromozomů (tvoří se jen shluky chromatinu) - deriváty akridinu - tripoflavin,
proflavin.
c) jedy mitotických organel - znemožňují
tvorbu dělícího tělíska, ostrosféry, metafázní destičky a tím i rozestup
chromozómů v anafázi - výsledek polyploidní buňka antikoagulancia -
hirudin, heparin, ixodin, fyzikální prostředí - tepelné šoky,
hydrostatický tlak.
d)
d)
Vřeténkové jedy - zabraňují vzniku dělícího vřeténka -
polyploidizace buněk podobně jako u předchozích - kolchicin (alkaloid),
dusíkaté báze na základě chinonu.
3. Život buňky – buněčný cyklus
Definice:
Buněčný cyklus = interfáze (klidové období) + mitóza
(období dělení). (URL
171)
Generační čas buňky = mitotický čas + interfáze
Mitotický čas = celá doba mitózy (10 minut až hodiny)
Mitotický index:
|
Mitotický index = |
Počet buněk v mitóze |
X 1000 |
|
Celkový počet buněk |
Příklad: Závislost mitotického indexu buněk v kořeni
rostliny v závislosti na vzdálenosti od jeho čepičky:
Generační čas buňky se mění v rozmezí od 10
minut (rýhující se vajíčko) až po léta (tkáňové buňky) nebo celý život (u
nervových buněk).
Buněčný cyklus:
|
|
G0 – fáze naprostého klidu (může i nemusí být) Další fáze se nazývají podle toho, zda se syntetizuje či nikoli DNK. G1 – presyntetická fáze, klidové období (pokud jde o DNK),
syntetizuje se RNK, roste počet ribozómů, mitochondrií, zásoba nukleotidů. S - syntetizuje se DNA, dochází k replikaci DNK molekul
(chromatid) v jádře. Obě molekuly DNK jsou spojeny v místě
centroméry, původní (matrice) si ponechá staré histony, druhá použije nově
syntetizované. Pokud jde o syntézu DNK v mitochondriích (a
chloroplastech), ta je nezávislá na syntéze DNK v jádře. Jen
v období mitózy se zastavuje. G2 – postsyntetická fáze ---- klidové (co do syntézy DNK)
období před mitózou, syntetizuje se RNK, buňka roste (po růstu DNK
v jádře se zvětší i množství cytoplazmy), syntetizují se proteiny,
zejména ty, které jsou potřebné pro nastávající mitózu ( např. tubulín). M – mitóza – karyokineze D - dělení buňky – cytokineze |
Proteiny se syntetizují prakticky po celou interfázi.
Doba trvání buněčného cyklu a relativní délky jeho
jednotlivých stupňů závisí na druhu buňky, stupni její diferenciace a na
okolních podmínkách (signalizace z mimobuněčného prostředí). Buňky
embryonálních tkání se dělí často, jiné např. jen při nápravě poškození.
Terminální diferenciace – většinou nastává po určitém
počtu dělení. Dochází k restrikci určitých genů a naopak k aktivaci
těch, které jsou pro konečnou funkci buňky důležité.
Regulace
buněčného cyklu (viz též URL 94)
Buněčný
cyklus je ovládán pomocí tzv. regulačních uzlů.
První regulační uzel se
nachází v G1 fázi a rozhoduje, zda buňka vstoupí do fáze syntetické, druhý
regulační uzel se nachází v G2 fázi a rozhoduje, zda buňka vstoupí do fáze
mitotické. Oba uzly souvisejí s činností bílkovin zvaných cykliny a na nich
závislých enzymů nazývaných kinázy.
Třetí regulační stupeň se
údajně nachází uprostřed mitózy, kde proteolytické enzymy na začátku anafáze
řídí separaci centromér.
Podrobnosti k mitóze
viz též na (URL
100) a k regulaci mitózy na (URL
101).
2.3.1. 2.3.1.
Buněčná smrt –apoptóza
Každá diferencovaná buňka
má konečnou dobu života.
Buňky mohou odumírat
dvěma způsoby:
·
·
Jsou zabity škodlivými vlivy.
·
·
Jsou podníceny k samozničení (suicide).
Smrt poškozením
Buňky,
které jsou ničeny škodlivými vlivy, např.
·
·
mechanicky
·
·
toxickými chemikáliemi
procházejí
charakteristickými změnami:
·
·
Buňky, stejně jako jejich organely, např. mitochondrie zduří následkem ztráty schopnosti cytoplasmatické
membrány kontrolovat tok látek (iontů a vody).
·
·
Obsah buňky uniká do extracelulárního prostředí, což vede k
·
·
zánětu (inflammation) okolní tkáně.
Smrt samozničením (suicide)
Buňky, které jsou vedeny
k samozničení:
·
·
zmenšují se (scvrkávají se - shrink);
·
·
na povrchu se objevují bublinovité útvary;
·
·
dochází k degradaci chromatinu
(chromatin = DNA a protein) v jádře;
·
·
mitochondrie se rozpadají , dochází k uvolňování cytochromu-
c;
·
·
Buňky se rozpadají do malých fragmentů obalených membránou.
·
·
Fosfolipid fosftidylserin, který je normálně skryt v
plazmatické membráně, se objevuje na povrchu.
·
·
To je podnětem pro receptory na fagocytech
(jako makrofágy
a dendritické
buňky), které pak buněčné fragmeny pohltí.
·
·
Fagocyty sekretují cytokiny
, které inhibují zánět
(např IL-10
and TGF-β)
Průběh buněčné smrti sebezničením se běžně nazývá programovaná buněčná smrt (programmed
cell death neboli PCD). Zánik buňky popsaným způsobem je pro buňky
tak charakteristický jako např mitóza.
Programovaná smrt buněk se nazývá apoptóza .
(apoptosis)
Proč by mělo docházet k samovolné likvidaci buněk?
Ze dvou hlavních důvodů:
1. Programovaná smrt buněk je potřebná
ke správnému vývoji, podobně jako mitóza.
Příklady:
·
·
Resorpce ocásku pulce v době jeho metamorfózy v žábu se děje pomocí
apoptózy.
·
·
Formování prstů na rukou a nohou během embryonálního vývoje vyžaduje
odstranění přebytečných buněk v daném prostrotu prostoru.
·
·
Odloučení vnitřní výstelky dělohy (endometrium) při zahájení menstruace
se děje prostřednictvím apoptózy.
·
·
Vytvoření správných spojení (synapsí)
mezi neurony vyžaduje odstranění přebytečných buněk pomocí apoptózy.
2. Programovaná buněční smrt je nutná k
odstranění buněk, které představují ohrožení integrity organizmu.
Příklady:
Buňky infikované viry
Jedna z metod, kterou cytotoxické
T-lymfocyty (CTLs) zabíjejí viry infikované buňky, je indukce jejich
apoptózy. [diagram
mechanismu].
Buňky imunitního systému
Když buněčně
zprostředkovaná imunitní odpověď klesá, effektorové buňky musejí být
odstraněny, aby se zabránilo tomu, že napadnou důležité orgány. CTL buňky indukují
apoptózu mezi sebou navzájem, dokoncei samy v sobě. Defekty v apoptickém
procesu vedou k autoimunitním problémům (autoimunitní
choroby jako lupus
erythematosus a rheumatoid
arthritis.
Buňky s poškozením
DNA
Poškození vlastního
genomu může u buňky vést
·
·
k přerušení dokonalého embryonálního vývoje s následnými vrozenými
vadami
·
·
tmohou se stát rakovinnými buňkami.
Na poškození DNA
odpovídají buňky vzestupem produkce p53
- (potent inducer of apoptosis). Není tedy divu, že mutace v genu p53
(který produkuje ochranný protein) se tak často nacházejí v rakovinných
buňkách, které, když se ponechají na živu, představují letální ohrožení
organizmu.
Rakovinné buňky
Radiace a chemikálie,
které se používají v terapii rakoviny, indukují v některých typech rakoviny
apoptózu nádorových buněk.
Co vede buňku k indukci apoptózy?
Narušení rovnováhy mezi
pozitivními a negativními signály:
·
·
zmizení, pokles, pozitivních signálů , tedy signálů potřebných k
poračování života, a
·
·
příjem signálů negativních.
Ústup pozitivních signálů:
Pokračující
přežívání buněk vyžaduje nepřetržitou stimulaci od buněk okolních a pro mnoho
typů pokrqčující adhezi k podkladu, na kterém rostou. Příklady pozitivních
sinálů:
·
·
růstové faktory pro neurony
·
·
Interleukin-2 (IL-2),
základní faktor pro mitózu lymphocytů
Příjem negativních signálů
·
·
rostoucí úroveň oxidantů uvnitř buňky
·
·
poškození DNA těmito oxidanty nebo jinými činiteli, jako
o o
UV (ultraviolet
light) záření
o o
x-paprsky
o o
chemoterapeutika
·
·
akumulace protienů, které ztratily schopnost správné tvorby své terciární
struktury.
·
·
molekuly, které se váží na specifické receptory na povrchu buněk a
signalizují, že buňky se nachází v apoptickém programu. Mezi tyto aktivátory
smrti patří např:
o o
Tumor necrosis factor-alpha (TNF-α ),
který se váže na TNF
receptor;
o o
Lymphotoxin (známý také jako TNF-β ), který se též
váže k TNF receptoru;
o o
Fas ligand (FasL), molekula, která se váže k
povrchovému buněčnému receptoru jeménem Fas (též známý jako CD95).
Mechanizmus apoptózy
Známe 3 rozdílné průběhy
programované buněčné smrti.
1.
1. Jeden
vyvolaný signály pocházejícími zevnitř
buňky;
2.
2. Další,
spouštěný tzv. aktivátory smrti
vázanými k receptorům na povrchu buňky:
o o
TNF-α
o o
Lymphotoxin
o o
Fas ligand (FasL)
3.
3. Třetí,
jenž může být spuštěn přítomností nebezpečných kyslíkových radikálů
4.
4. Apoptóza
vyvolaná vnitřními signály: tzv. vnitřní, neboli 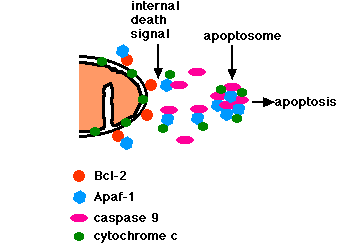 mitochondiální
cesta
mitochondiální
cesta
·
·
V buňce
vznikají pomocí mitochondiálních faktorů,
cytochromu-c, tzv. kaspáz a energii dodávajícího ATP tzv. apoptozómy,
které se agregují v cytosolu, jsou postupně proteolyticky rozloženy kaspázami (c-9 a j), DNA je degradována a
buňky nakonec fagocytovány.
·
·
Ve zdravých buňkách vystavují vnější membrány mitochondrií na svém
povrchu protein Bcl-2
·
·
Bcl-2 se váže na molekulu proteinu Apaf-1 ("apoptotic
protease activating factor-1").
·
·
Vnitřní poškození buňky, například reaktivními kyslíkovými radikály,
způsobuje
o o
Bcl-2 uvolní Apaf-1;
o o
Příbuzný protein, Bax,
prochází mitochondriálními membránami a způsobuje, že
o o
cytochrom
c uniká.
·
·
Uvolněný cytochrom c a Apaf-1 se váže na molekuly kaspázy 9.
·
·
Vzniklý komplex
o o
cytochrom c
o o
Apaf-1
o o
caspáza 9
o o
(a ATP)
se
nazývá apoptozóm.
·
·
V cytosolu dochází k jejich agregaci.
·
·
Kaspáza 9 je jedna z rodiny více než deseti kaspáz. Jsou to proteázy.
Jmenují se tak proto, že štěpí proteiny – většinou jedna druhou – v místě
zbytků kyseliny aspartové (Asp).
·
·
Kaspáza 9 štěpí a tím aktivuje ostatní kaspázy.
·
·
Postupná aktivace jedné kaspázy druhou vytváří rostoucí kaskádu
proteolytické aktivity (trochu podobnou blood
clotting a aktivaci komplementu),
vedoucí k
o o
trávení strukturálních bílkovin cytoplazmy
o o
degradaci chromozomální DNA a
o o
fagocytóze buňky
2. Apoptóza spuštěná vnějšími signály:
tzv cesta vnější, neboli přes receptory smrti.
Vede
postupně k aktivaci kaspásy-8, následně dalších kaspáz, které provedou
proteolýzu buněčných struktur. Následuje fagocytóza.
Počáteční
stupně apoptózy mohou být reverzibilní (přinejmenším u C. elegans). Za
jistých okolností apoptóza proběhne, jen je-li zaručena fagocytóza
odumírajících buněk.
·
·
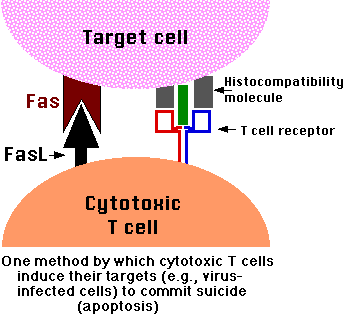
Fas a TNF receptor
jsou integrální
membránové proteiny s receptorovými doménami vystavenými na povrchu
buňky
·
·
Vazba komplementárního aktivátoru smrti (death activator) – FasL,
případně TNF – přenáší do cytoplazmy signál vedoucí k
·
·
aktivaci kaspázy 8
·
·
Kaspáza 8 (stejně jako kaspáza 9) zahajuje kaskádu aktivace kaspáz
vedoucí k
·
·
fagocytóze buňky
Příklad (viz
obr.): Když cytotoxické
T-buňky rozeznají svůj cíl a naváží se na něj,
·
·
produkují na svém povrchu více FasL,
·
·
ten se váže s Fas na povrchu cílové buňky, což vede
k její apoptotické smrti.
Počáteční stadia
apoptózy jsou reverzibilní, přinejmenším u C.
elegans. V některých případech je konečná destrukce buňky
zajištěna pouze spolu s jejím pohlcením fagocytem.
3. Přes apoptózu indukující faktor
(Apoptosis-Inducing Factor - AIF)
Neurony a snad i jiné buňky mají jiný způsob vlastní destrukce, který na
rozdíl od obou výše popsaných neužívá
kaspáz.
Apoptózu indukující
faktor (AIF) je protein, který je normálně lokalizován v prostoru mezi
membránami mitochondrií.
Jestliže buňka obdrží signál, že nastal čas smrti, AIF
·
·
se uvolní z mitochondrií (podobně jako cytochrom-c v prvním
případě;
·
·
migruje do jádra;
·
·
váže se na DNA, která
·
·
spouští destrukci DNA a buňka hyne.
Apoptóza a rakovina
Některé viry spojené s nádory používají různé triky
k zabránění apoptóze buněk které transformují.
·
·
Některé lidské papiloma
viry (human papilloma viruses
- HPV) jsou jednou z příčin vzniku rakoviny krku. Jeden
z nich produkuje protein (E6) který se váže na p53 (protein potlačující vznik nádorů)
a inaktivuje jej
·
·
Epstein-Barrův virus (EBV), který je příčinou
mononukleózy a je spojován s některými lymfomy,
o o
produkuje protein podobný Bcl-2
o o
Produkuje další protein, který způsobuje, že buňka zvýší vlastní
produkci Bcl-2
Oba tyto způsoby činí buňku rezistentnější vůči
apoptóze a tím umožňují rakovinné buče se dále množit
I ty nádorové buňky, které vznikají bez spolupůsobení virů, mohou
používat triků k zabránění apoptóze.
·
·
Některé leukémie a lymfomy B-buněk vykazují vyšší hladinu Bcl-2,
čímž blokují případné signály vedoucí k apoptóze (diskuze)
·
·
Buňky melanomů (nejnebezpečnějšího typu rakoviny kůže) se
vyhýbají apoptóze inhibucí genu kódujícího Apaf-1.
·
·
Některé nádorové buňky, zvláště rakoviny plic a tlustého střeva,
vylučují zvýšené hladiny rozpustných molekul fungujících jako „návnada“. Ty se
váží k FasL, čímž zabraňují jeho vazbě na Fas. V důsledku toho
cytotoxické T-buňky (CTL) nemohou zabíjet rakovinné buňky výše zmíněným
mechanismem.
·
·
Jiné rakovinné buňky vystavují vyšší hladiny FasL, a mohou zabíjet
jakékoliv cytotoxické T-buňky které se je pokusí zabít, protože ty také vystavují
Fas (ale jsou chráněny proti vlastním FasL).
Apoptóza v imunitním systému
Imunitní
odpověď vůči cizímu vetřelci zahrnuje proliferaci lymfocytů
– T a B-buněk. Když tyto splní svůj úkol, musí být z organismu odstraněny
až na malou populaci tzv. paměťových buněk. To se děje pomocí apoptózy.
Velice
zřídka se u lidí vyskytuje genetický defekt apoptózy. Nejčastěji je to mutace
genu pro Fas, ale občas se vyskytují i mutace genů pro FasL nebo i pro některou
kaspázu. Ve všech těchto případech dochází k tzv. autoimunitnímu
lymfoproliferativnímu syndromu ( ALPS ).
Projevy:
·
·
Hromadění lymfocytů v lymfatických uzlinách a slezině je značně
zvětšuje
·
·
Objevují se klony které jsou autoreaktivní, což znamená že napadají
vlastní složky a vedou k autoimunitním chorobám jako je hemolytická anémie
nebo trombocytopenie
·
·
Objevení se lymfomu (rakovinného klonu lymfocytů)
U
většiny pacientů s ALPS se mutace nachází ve všech tělních buňkách. Někdy
je však mutace somatická,
to znamená že se objevuje pouze u některých buněk prekurzorů v kostní
dřeni. Tito pacienti jsou genetické
mozaiky – u
některých lymfocytů dochází k normální apoptóze, u jiných nikoliv a tyto
mají tendenci přerůstat populaci normálních buněk v lymfatických uzlinách
a v krvi.
Apoptóza a AIDS
Hlavním rysem AIDS
(acquired immunodeficiency syndrome) je
pokles počtu pacientových CD4+
T buněk (normálně je jich asi 1000/µl
krve). Tyto buňky zodpovídají přímo nebo nepřímo (jako tzv. helper
cells) za veškerou imunitní odpověď. Pokud jejich počet poklesne pod
200/µl, pacientův organismus není schopen
účinné imunitní odpovědi a podléhá mnoha nebezpečným infekcím. Co je příčinou
mizení CD4+ T buněk?
HIV
(human immunodeficiency virus) napadá CD4+ T buňky a dalo by se předpokládat, že tato jejich
infekce virem HIV je příčinou jejich značného úhynu. Ukazuje se však, že toto není hlavní příčina. Ve skutečnosti je
virem infikována méně než 1 ze 100 000 CD4+ T buněk v krvi. To, co zabíjí tak mnoho CD4+ T
buněk, je veskutečnosti apoptóza.
Mechanismus není zcela
jasný, nabízí se několik možností. Jedna z nich je následující:
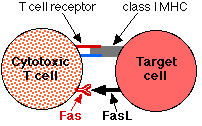
·
·
Všechny T-buňky, infikované i neinfikované, vystavují Fas
·
·
Exprese genu HIV (zvaného Nef) v buňkách infikovaných HIV
způsobí
o o
buňky vystavují na svém povrchu větší množství FasL
o o
přitom brání interakci se svým vlastním Fas, aby nedošlo k samodestrukci
·
·
Pokud se však infikovaná T-buňka setká s neinfikovanou (např.
v lymfatické uzlině), interakce FasL s Fas neinfikované buňky tuto
zabije oimocí apoptózy
Apoptóza a orgánové transplantáty
Již dlouho je známo že určité části těla jako
·
·
přední komora oční
·
·
varlata
jsou „imunologicky
privilegovaná místa“. Antigeny uvnitř nich nedokáží vyvolat imunitní odpověď.
Buňky v těchto místech se liší od ostatních buněk v těle v tom,
že stále vystavují vysoké hladiny FasL. To znamená, že T-buňky, reaktivní
na antigen, které vystavují Fas, jsou po vniknutí do těchto míst
usmrceny. (jedná se o opačný mechanismus než je popsáno výše)
Tento fakt ukazuje na
možnost nového způsobu prevence odvrhnutí
transplantátu. Pokud aspoň některé buňky transplantované ledviny, jater,
srdce atd. lze přimět k vystavení vyšších hladin FasL, bylo by možno takto
chránit transplantát před útokem T-buněk hostitelského buněčného
imunitního systému. V takovém případě by se současná potřeba imunosupresívních
léků po zbytek života příjemce transplantátu mohla snížit nebo i
eliminovat.
Výsledky
experimentů na zvířatech však dosud nejsou jednoznačné. Allogenní
štěpy připravené tak aby vystavovaly na povrchu svých buněk FasL vykazovaly
zvýšenou dobu přežití u ledvin, ale nikoliv u srdcí nebo Langerhasnsových ostrůvků.
Apoptóza v rostlinách
I rostliny mohou
zapnout systém programované buněčné smrti, například jako pokus zastavit šíření
virové infekce.
Příslušný
mechanismus se liší od mechanismu apoptózy u živočichů, ačkoliv též zahrnuje
působení proteáz, které – stejně jako kaspázy – štěpí jiné proteiny v místech zbytků Asp (a
Asn). Aktivací těchto enzymů dojde ke zničení centrální
vakuoly, což má za následek zničení celého zbytku buňky
4. MEIÓZA
- dělení redukční (zrací)
(Viz též velmi dobré
URL
96, kde jsou podrobně popsány jednotlivé fáze meiózy i mitózy.)
Meiózou se nazývá specifické dělení buněk, jehož
cílem je vznik buněk pohlavních.
Při tomto procesu dochází
1.
1.
k redukci počtu chromozómů. (Proto je tento typ běžný při vzniku buněk
pohlavních , kde jejich splynutím (zygota) se počet chromozómů opět upravuje na
normální 2n stav.)
2.
2.
k rekombinaci dědičných vloh po otci a matce tzv. segregací chromozómů (náhodný rozchod otcovskýcch a mateřských
chromozómů do dceřinných buněk) nebo navíc i pomocí tzv. crossing overu.
Meiotické dělení
jsou v zásadě dvě na sebe
navazující mitózy. První dělení se
od mitözy podstatně liší profází a nazývá se heterotypické dělnení.
Druhé dělení je v zásadě s mitózou totožné a proto se mu říká homoypické.
Buňky se v tomto procesu rozdělí dvakrát, ale
chromozómy jen jednou. Výsledkem jsou normálně 4 buňky s polovičním
počtem chromozómů.
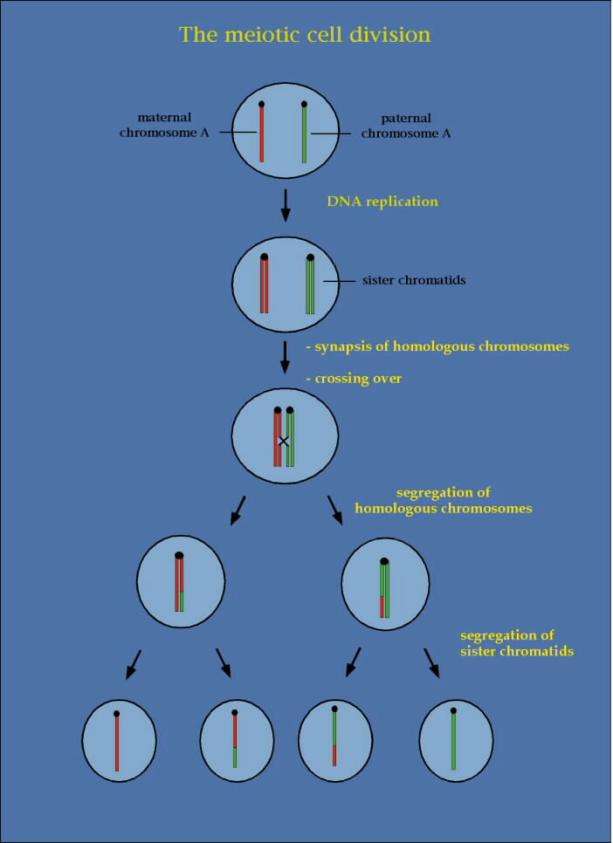
4.1. PRVNÍ ZRACÍ DĚLENÍ
4.1.1. PROFÁZE:
Probíhá v jádře. Rozeznáváme 5 stadií:
LEPTOTEN
ZYGOTEN
PACHYTEN
DIPLOTEN
DIAKINEZE
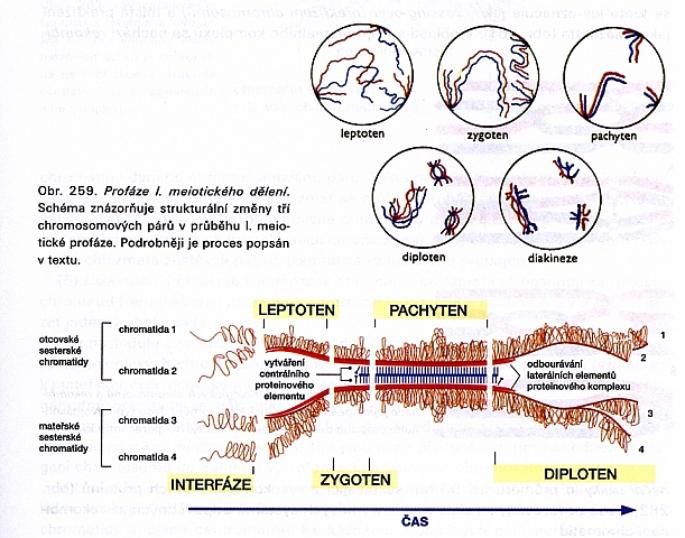
Meiósa podle Nečase a kol (2000). Důležitá je existence tzv. synaptonemálního komploexu
(zde centrální proteinový element) bílkovin, které váží nesesterské chromatidy
k sobě a umožňují správnou výměnu úseků (tedy průběh crossing overu). Viz
též rekombinační uzlík níže.
a) LEPTOTEN - V jádře se objevuje dlouhé vláknité chromozómy, orientované konci k
povrchu jádra v místě centriolu – vzniklý útvar se nazývá buket .
Někdy zůstává rozložení chaotické.
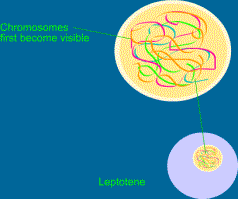 Převzato z www
Převzato z www
b) ZYGOTEN - Podélné sbližování a spojování (syndeze) homologních
chromozomů centrálním elementem synaptonemálního komplexu (bílkoviny, které
dvojice drzí u sebe). Vzniklé dvojice homolögních chromozömů se nazývají bivalenty.
Mezi nimi zůstvá zachována tzv. redukční štěrbina.
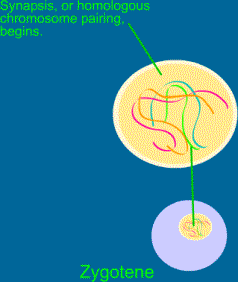 Převzato z www
Převzato z www
c) PACHYTEN - Spiralizace bivalent - zkracují se a zesilují.
Homologní chromozómy se vzájemně ovíjejí a proplétají. Současně se každý
chromozóm podélně štěpí na 2 chromatidy - vznikají terády - ekvační
štěrbina (uplatnila by se v mitóze, kde se jedná o stejný, ekvální,
počet chromozómů). Dochází i k překřížení nesesterských chromatid
homológních chromoz¨omů (crossing over) V takových místech může
dojít k výměně překřížených úseků DNA histonových komplexů. Během crossing
overu - překřížení dojde k rozpojení chromatid na fragmenty a k jejich
opětnému spojení během pokračující meiózy, ale tak, že se napojí v přímé linii,
nikoli podle překřížení. Každá ze čtyř původních chromatid má tak po crossing
overu zcela originální genotypickou podobu. Dojde ke kombinaci
genetického materiálu po obou rodičích producenta.
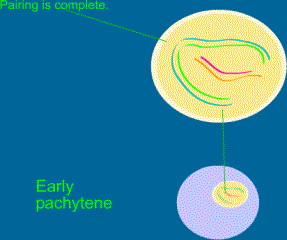
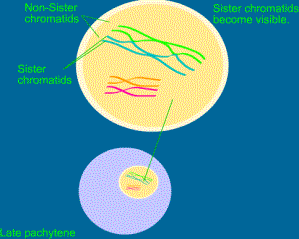 Převzato z www
Převzato z www
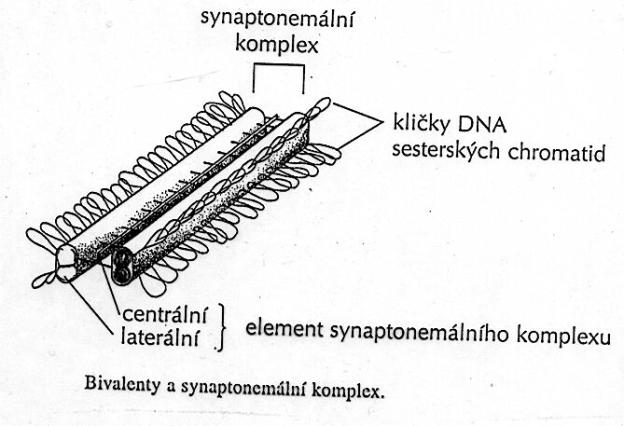
Místo, kde nastává crossing over, je proměnlivé.
Samotná rekombinace je zřejmě řízena složitým bílkovinným komplexem, který se
nazývá rekombinační uzlík. Meióza je tedy velice delikátní enzymayticky kontrolovaný
proces.
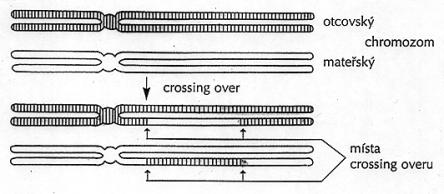
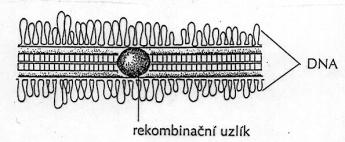
(Podle
Kubišty, 1998)
d) DIPLOTEN
- Rozestup homologních chromozómů v
tetrádách (redukční štěrbina). Synaptonemální komplex se odbourává. V některých
místech zůstávají tetrády srostlé, nabývají tvaru X - tvoří tzv. chiazmata. Chiasmatypie může trvat dlouho -
ve vaječných buňkách obratlovců i několik let. Postupně tetrády tloustnou a
zkracují se a překřížení se posunuje ke koncům. Všechny tetrády ke konci mají
postupně kruhovitý tvar, nastává poslední stadium - diakinéze.
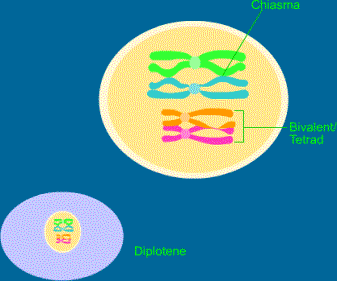 Převzato z www
Převzato z www
e)
DIAKINEZE - Diakinezí končí profáze
1. zracího dělení, buňka vstupuje do metafáze.
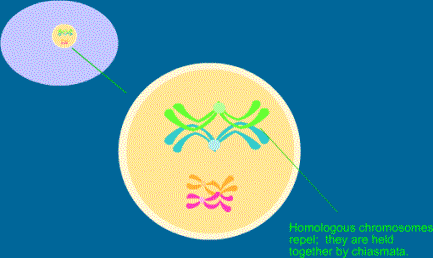
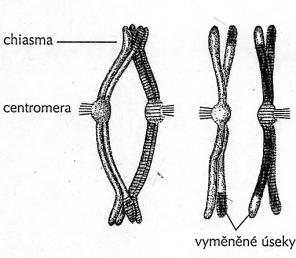
Převzato z
www
4.1.2. METAFÁZE 1. ZRACÍHO DĚLENÍ
Jaderná blána se rozpadá, chromozómy (dvojice
kruhovitého tvaru) se shromažďují v equatoriální rovině, ale tak, že centromery
homologních chromozómů směřují k protilehlým pólům buňky a napojují se na
dělící vřeténko, které se mezitím vytvořilo.
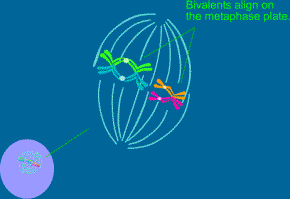 Převzato z www
Převzato z www
4.1.3. ANAFÁZE 1. ZRACÍHO DĚLENÍ
Stejná jako u normální mitózy, ale k pólům buňky jdou
nikoli chromatidy, ale jednotlivé chromozómy homologních párů (ovšek
zrekombinované).
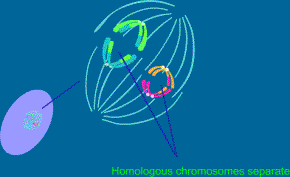 Převzato z www
Převzato z www
4.1.4. TELOFÁZE 1. ZRACÍHO DĚLENÍ
Rekonstrukce jader s haploidním počtem chromozómů
(ale stejným množstvím DNK jako při norm. mitóze – každý chromozóm má zatím obě
chromatidy). Telofáze bývá zakončena rozdělením buňky. (Někdy však 2.
zrací dělení přímo navazuje na anafázi 1. zracího dělení, takže se diády
rozštěpí a putují do dceřinných buněk bez formace diploidncíh jader.
 Převzato z www
Převzato z www
4.2. DRUHÉ ZRACÍ DĚLENÍ
Stejný průběh jako normální mitóza - rozdělí se
jednotlivé chromatidy v diádách (v polovičním počtu chromozómů. Po anafázi
vzniknou celkem 4 jádra o 1 počtem chromozómů a polovičním množstvím DNK ve
srovnání s norm. mitózou.
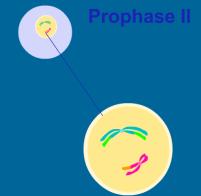
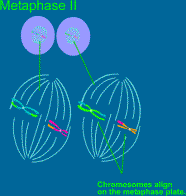
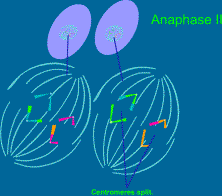

Převzato
z www
4.3. Průběh
meiózy samčích (žlutě) a samičích (červeně)
buněčných linií.
Pohlavní buňky vznikají
z tzv. primordiálních gonocytů (prapohlavních buněk), ktreré
si organismy uschovají v procesu embryonálního vývoje do doby tvorby
pohlavních orgánů zárodků. Jakmile vzniknou zárodečné epitely, schopné starat
se o výživu prapohlavních buněk, prapohlavní buňky do pohlavních orgánů
vcestují a usadí se v ních. Podle řízení neurohumorálním systémem začnou
se pak v pravý čas prapohlavní buňky mitoticky dělit (rozmnožovací fáze) a
dávají tak vznik několika generacím (až 256 kusů) tzv. gametogonií
(spermatogonie a oogonie). Ty pak vstupují do tzv. růstové fáze a dávají vznik
gametocytům 1. rádu (primární spermatocyt, nebo oocyt). Gametocyt 1. řádu po prvním
meiotickém dělení dává vznik 2 gametocytům 2. řádu (sekundární spermatocyt nebo
oocyt). Ty prodělávají druhé meiotické dělení a dají vzniknout celkem 4 dosud
nezralým gametám (spermatidy, ootida), které v tzv. zracím období
dozrávají ve sperie nebo vajíčko (ovum). V samčí linii vznikají 4
stejnocenné spermie, zatímco v linii samičí při obou meiotických děleních
vzniká jediná velká buňka a tzv. pólové (reziduální) tělísko. Cytoplazmu si
ponechá budoucí vajíčko a do pólových buněk jsou deponovány přebytečné sady
chromozómů. Pokud se první pólová buňka při 2. meiotickém dělení také rozdělí,
může celkem vzniknout jediné vajíčko a 3 reziduální tělíska. Vaječné buňky
obsahují někdy tak obrovské možství živných látek v cytoplazmě, že patří
mezi největší živočišné buňky (žloutek ptačích vajíček).
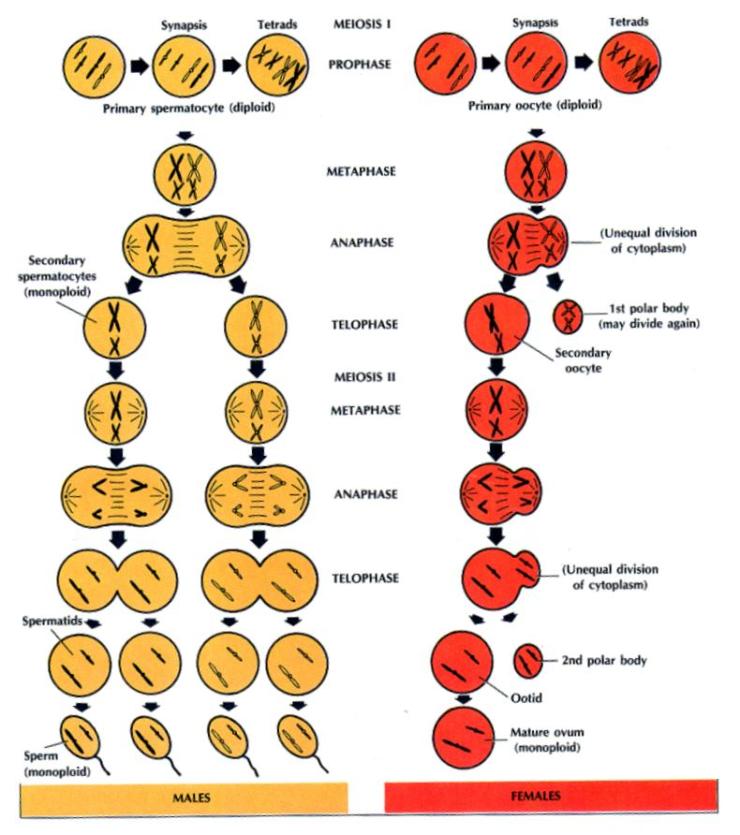
Převzato z www.
Viz též URL 97
– www stránka o vývoji vajíčka (v angličtině)
Níže ještě jednou srovnání mitózy a meiózy podle URL 91 :
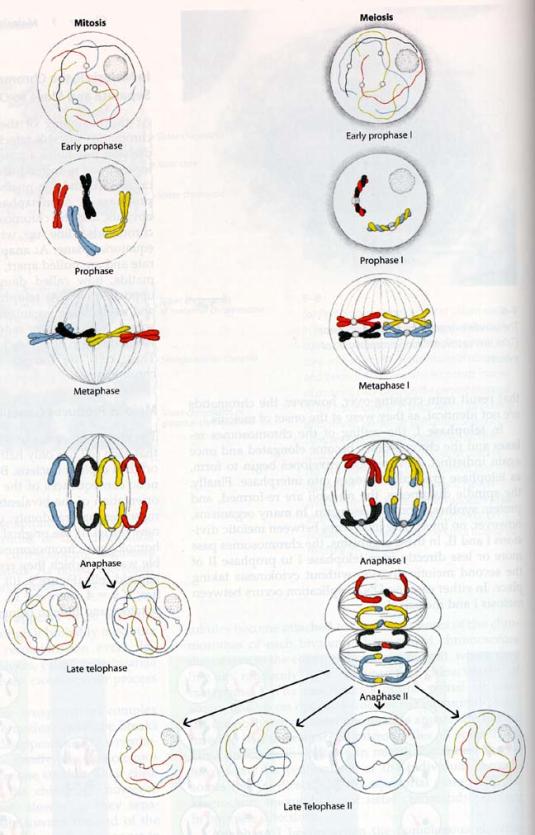
3.
3. Struktura
DNA a přepis genetické informace (URL 115)
3.1.
3.1.
DNA – primární,
sekundární a terciální struktura
3.2.
3.2.
Mitochondriální DNA
3.3.
3.3.
Replikace DNA
3.4.
3.4.
Přehled transkripce a
translace
3.5.
3.5.
DNA - RNA (transkripce)
3.6.
3.6.
RNA – bílkoviny
(translace)
3.7.
3.7.
Struktura ribozómů
Gen: je to krátký úsek molekuly DNA, který kóduje jednu
RNA nebo jeden protein.
Prokaryotický gen obsahuje nepřerušované úseky DNA, které jsou
transkribovány do RNA. Ta potom po dalších úpravách slouží jako mRNA a kóduje
sekvenci aminokyselin celého proteinu
Eukaryotický gen obsahuje kódujíci sekvence (exony), které
jsou transkribovány do RNA a kódují aminokyselinovou sekvenci části proteinu.
Ty jsou přerušované nekódujícími sekvencemi (introny), které jsou též
transkribovány do RNA, ale potom vystřiženy RNA sestřihem (nekódují žádný
protein) čímž teprve vzniká mRNA.
Většina genů kóduje
nějaký protein. Tento proces probíhá ve dvou stupních:
1.
1.
Transkripce = DNA → RNA
2.
2.
Translace = RNA → bílkovina
Dohromady se tyto dva
procesy označují jako
centrální dogma molekulární biologie
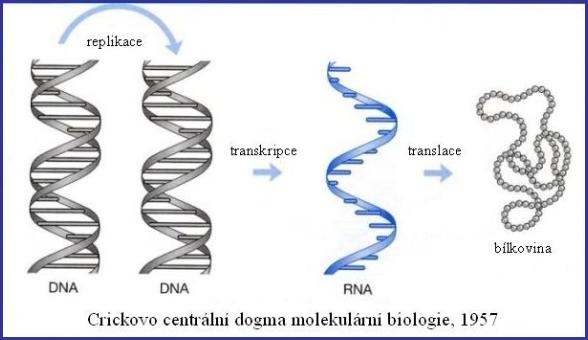
3.1.
3.1. DNA – primární, sekundární a terciální
struktura (URL
99 - animace, URL 110
– francouzsky)
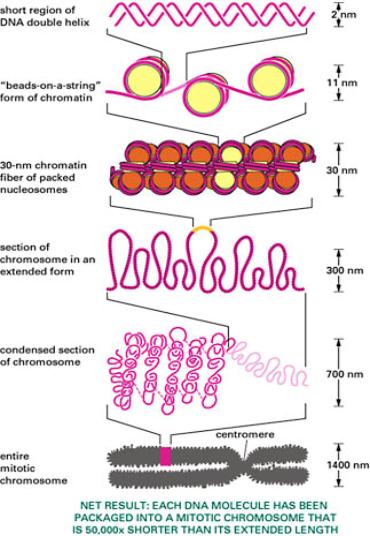
Převzato z www
DNA se
v jádře eukaryotické buňky nachází ve formě chromozomu, jehož základem je
asi 2 nm silná dvoušroubovicová molekula DNA (sekundární struktura DNA).
Y a X lidský
chromozóm. Převzato z URL 111.
Sekundární
struktura DNA
Dvoušroubovice DNA se může
vyskytovat ve třech různých formách, z nicž nejobvyklejší je B-DNA.
Obrázek ukazuje vlevo strukturu B-DNA, uprostřed A-DNA a vpravo Z-DNA. Modrá a
bílá barva označuje atomy cukrfosfátové kostry, červená a žlutá páry bází.
Převzato z URL 113,
viz též URL
108.
Molekula DNA se
nechová jako pevná a neměnná struktura, její krystalografické parametry
představují průměrné hodnoty. Ve skutečnosti v ní dochází k neustálým
termálním a jiným fluktuacím, jejichž výsledkem bývá pootočení, natažení,
ohnutí či rozvinutí dvojité šroubovice. Navíc určité sekvence v primární
struktuře DNA vedou k trvalému ohybu či jiným změnám struktury DNA
dvoušroubovice. Tyto lokální sekvenčně specifické fluktuace jsou nezbytné pro
rozeznání specifických vazebných míst na molekule DNA, na která se váží proteiny
nezbytné pro replikaci, transkripci, regulaci exprese genů nebo opravu
poškození v DNA. (Sekundární strukturu DNA in vitro lze sledovat například
spektrofotometricky pomocí cirkulárního či lineárního dichroismu.)
|
|
|
Parametry různých konformací DNA. Převzato z URL
168.
Terciální struktura, tvořená nejprve tzv. nukleozómy,se vytváří dvojitým obtáčením kolem
oktamerů bazických bílkovin – histonů. Na tvorbě struktury nukleozómů se kromě
čtyř typů histonů (dva H2A, dva H2B, dva H3 a dva H4) podílí i vazba pátého
typu histonu, H1 (viz obr.). Vzniklý nukleoprotein se označuje jako 10
nm-chromatinové vlákno a představuje dekondenzované chromozómy
v euchromatinu během interfáze, kdy se buňka nedělí. Za přítomnosti histonu H1 chromatin
kondenzuje do tzv. 30 nm-chromatinového vlákna, ve kterém jsou nukleozómy
uspořádány do struktury solenoidu.
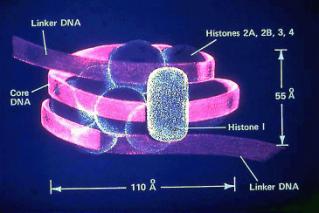
Převzato z URL
114
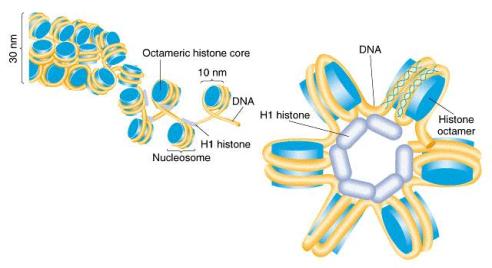
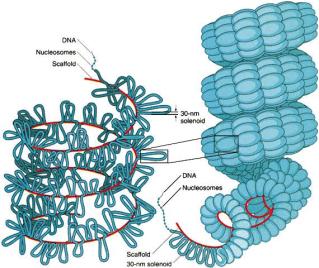
Převzato z www
Toto 30 nm-chromatinové vlákno se váže ve formě smyček, označovaných
jako chromatinové domény (looped domains) k tzv. proteinovému lešení
(scaffold proteins – URL
192, URL 115),
tvořenému proteiny nehistonové povahy.Tloušťka takto vzniklého vlákna je asi
300 nm. V úpatí každé smyčky se nachází molekula topoizomerázy II, která
je zřejmě důležitá při transkripci a replikaci DNA ve smyčce. Oblast DNA,
kterou se chromatinové vlákno vážer k proteinovému lešení, se označuje
jako připojovací oblast pro proteinové lešení neboli SAR (scaffold attachment
region). Tento úsek DNA je dlouhý asi 250 – 1500 kilobází (kb) a sestává ze
souvislého sledu bází A a T. Další kondenzací do tvaru spirály se vytváří asi
700 nm silná vlákna heterochromatinu, která vytváří strukturu metafázních
chromozómů. Nejvyšší stupeň kondenzace chromatinu představují mitotické
chromozómy, ve kterých je proto chromatin z hlediska transkripce
inaktivní.
3.2.
Mitochondriální DNA
Mitochondrie
(URL 116
– česky) mají svoji vlastní, mimojadernou kružnicovou (cirkulární) DNA (mtDNA
– URL
119). U člověka má délku 16569 párů bazí (bp). Obsahuje (URL
117 – česky) geny kodující dvě rRNA, 22 různých tRNA a 13 proteinů
potřebných pro fungování energetického metabolismu celé buňky. Od jaderného
genomu se mtDNA liší poměrně značnou rychlostí mutací, což je zřejmě způsobeno chybami
při replikaci, nepřítomností reparačních aktivit a a agresívním oxidačním
prostředím.
Tyto vlastnosti spolu
s faktem, že mitochondriální dNA se dědí pouze po matce, lze využít při
studiu lidské evoluce. Tak vznikla řada zajímavých objevů a teorií o původu
člověka (URL 118) a o
vztazích mezi jednotlivými lidskými rasami a populacemi.
Kromě toho se výše
uvedených vlastností mtDNA využívá i v soudním lékařství při identifikaci
osob, především z materiálů s velmi omezeným množstvím DNA, kde není
možno použít typických markerů jaderné dNA.
3.3.
3.3. Replikace DNA (URL 121, URL 122,)
Je to proces, kterým
buňka kopíruje své geny, aby je mohla předat buňkám dceřinným. Nedochází k ní
nahodile, její začátek je spojen s tzv. iniciačními faktory. Replikace je
semikonzervativní, což znamená, že jedno vlákno DNA je templátem pro tvorbu
nového vlákna. Za počátek replikace buněčné DNA zodpovídá interakce mezi tzv. replikačními
počátky (místa kde se DNA nejdříve otevírá (obsahují hlavně A-T páry bazí,
jejichž vazba je méně stabilní) a iniciačními proteiny, které jsou těmito
sekvencemi přitahovány a tak rozeznávají počátek replikace. Zatímco prokaryotní
genom obsahuje jediný počátek replikace, v genomu eukaryotní buňky jich
lze nalézt kolem 10 000. Iniciátory
katalyzují otevření duplexu DNA na místě začátku replikace a aktivizují činnost
celého replikačního mechanismu. Replikace DNA může probíhat pouze v jednom
směru, od 5´ k 3´ (pomocí enzymu DNA polymerázy), ale častěji probíhá na obou vláknech DNA (v protisměru pomocí
tzv. Okazakiho fragmentů, které jsou později spojovány).
Kromě DNA polymeráz je potřebí spousta dalších
proteinů (URL
123) jako strukturní a regulační faktory, které garantují přesné
zkopírování genomu tím, že je časově a prostorově koordinují s buněčným
cyklem okolních buněk. Navíc existují mechanismy kontrolních bodů, který řídí
cyklus mitózy, poskytují čas pro nápravu poškození a pro zpětnou rekonstrukci
po přechodu replikační vidlice.
Většina proteinů zahrnutých v procesu DNA replikace
je držena pohromadě ve velkém multienzymovém komplexu, který zajišťuje aby DNA
byla syntetizována na obou vláknech koordinovaně.
DNA v jádře má velmi
kompaktní kondenzovanou strukturu. Aby mohlo dojít k jejímu přepisu
(replikaci), je nutné aby se tato struktura rozvinula a obě vlákna
dvoušroubovice se v místě replikace od sebe oddělila. K tomuto účelu
slouží celá řada enzymů:
Enzymy sloužící k replikaci DNA (URL 109)
1. 1.
DNA helikázy – váží se k dvoušroubovici DNA a stimulují oddělení jejích
vláken
2. 2.
SSB proteiny (DNA single-stranded binding
proteins) – tetramer těchto proteinů se váže k DNA a stabilizuje
její jednořetězcovou strukturu, vzniklou působením helikáz. Pokud jsou na
jednořetězcovou DNA vázány tyto proteiny, je rychlost replikace asi 100x větší.
3. 3.
DNA gyráza – katalyzuje tvorbu
negativně zavinuté dvoušroubovice
4. DNA
polymerázy (URL
125) - V eukaryotických buňkách působí čtyři hlavní
jaderné DNA polymerázy, označované jako pol α,
pol δ, pol ε and pol σ. Pol α působí při iniciaci replikace
chromozomální DNA jak u vedoucího vlákna (leading strand), tak i Okazakiho
fragmentů na zpožďujícím se vlákně (lagging strand). DNA polymeráza má
pouze 5’- k -3’ polymerázovou aktivitu: katalyzuje přidání nukleotidů k 3’konci
rostoucího vlákna DNA ve dvou krocích:
1)
párování bází mezi nově vstupujícím nukleotidem a templátovým řetězcem
2)
vazba nově vstupujícího nukleotidu k novému vláknu DNA
DNA polymeráza má 3’- k -5’ korigující
(proofreading) aktivitu: opravuje nekomplementární báze přednostně na nově
syntetizovaném vlákně DNA. Před přidáním nukleotidu k rostoucímu vláknu DNA
kontroluje, jestli předchozí přidaný nukleotid se správně páruje s bází templátového
řetězce. Jestli ne, polymeráza odstraní nepárující se nukleotid a opakuje krok.
Vzhledem k tomu že DNA polymeráza
pouze připojuje nukleotid k párujícímu se nukleotidu v DNA dvou-šroubovici,
nemůže začít kompletně nové vlákno DNA.
Pro začátek nového vlákna DNA je třeba
odlišný enzym.
5.
5. Primáza - začíná nový polynukleotidový řetězec
jednoduše spojením dvou nukleotidů dohromady bez potřeby konce párujících se
bází a užití řetězce DNA jako templátu, produkuje krátké vlákno RNA (5 bp dlouhé – u prokaryot, 10 bp dlouhé – u
eukaryot), které slouží jako primer pro syntézu DNA a poskytuje 3’konec
párujících se bází jako začátek pro syntézu DNA polymerázy. Pro vedoucí vlákno
je použit pouze jeden RNA primer v replikačním počátku, pro zpožďující se vlákno
– RNA primer je produkován pro každý Okazaki fragment (v intervalu 1000 bp u
prokaryot a 200 bp u eukaryot).
6. Tři další kroky
a tři další enzymy jsou potřebné k tvorbě kontinuálního nového vlákna DNA z
mnoha oddělených fragmentů DNA vznikajících na zpožďujícím se vlákně: Nukleáza
odstraní RNA primer, opravná DNA polymeráza nahradí RNA za DNA a DNA ligáza
připojí 5’-fosfátový konec jednoho nového DNA fragmentu k 3’-hydroxylovému
konci následujícího fragmentu.
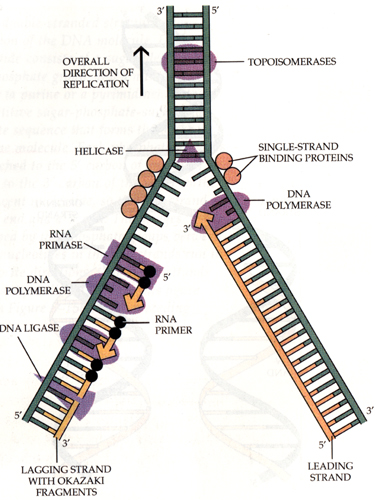
Převzato z URL
126.
Obecný
průběh replikace DNA (animace viz URL
124)
1.
1. Působením DNA gyrázy, DNA
helikázy a stabilizace pomocí SSB proteinů (DNA single-stranded binding
proteins) se molekula DNA rozvine a připraví na syntézu.
2.
2. Pro replikaci je potřebná volná
3´OH skupina, která ale po separaci řetězců templátové DNA není přítomna. Proto
dojde k syntéze RNA primeru, jehož volná 3´OH skupina je použita jako
začátek replikace, pomocí enzymu primázy.
3.
3. Replikační vidlice se pohybuje
jedním směrem, ale k replikaci DNA dochází pouze ve směru od 5´ k 3´
konci. Tento paradox řeší tzv. Okazakiho fragmenty. Jde o malé replikační
produkty opačného vlákna.
4.
4. Konečný produkt primerové úseky
RNA neobsahuje, protože je odstraní 5´ - 3´ exonukleázová aktivita polymerázy
I. Také v konečném produktu DNA nejsou žádné mezery jako důsledek
odstranění RNA primerů, protože ty svým působením zaplní DNA polymeráza (DNA
polymeráza katalyzuje vznik fosfodiesterické vazby mezi 5´-koncem
volnéhodeoxyribonukleotidtrifosfátu a 3´-koncem rostoucího řetězce.
5.
5. DNA polymeráza však není schopna
tvořit konečnou fosfodiesterickou vazbu mezi 3´-hydroxylovou skupinou a
5´-fosfátovou skupinou. Tu vytváří enzym DNA ligáza.
Telomery (URL
128 - česky, URL 134,
URL 135,)
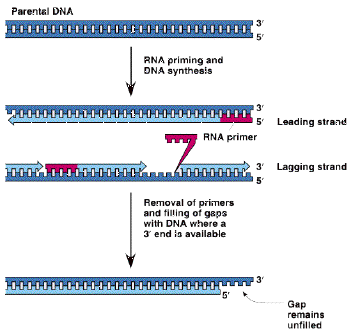
Problém 5' konce
(převzato z www)
Při replikaci
DNA vzniká na 5´ konci problém v tom, že 5´ konec zpožďujícího se vlákna nemá
dost místa pro primer posledního Okazakiho fragmentu. Proto DNA polymeráza
nemůže tento konec u dceřinného vlákna DNA dokončit. Tím se po každé replikaci
molekula DNA o kousek zkrátí. U prokaryot to není problém, protože jejich DNA
je kružnicová (cirkulární), ale u eukaryot tento problém nastává. Řeší ho
zakončení molekuly DNA opakujícími se nekódujícími sekvencemi bohatými na
guanin (např. TTAGGG), tzv. telomerami (URL131 - česky). Vzhledem
k tomu, že guanin je schopen tvořit tetramery, vytvářejí telomery na
koncích dvoušroubovice DNA úseky čtyřřetězcové DNA.
Počet opakování
těchto telomerových sekvencí je různý, mění se zhruba v rozsahu 100 až
1000. Telomery se při každé replikaci zkracují. Většina buněk se může dělit
zhruba 30krát než se jejich telomery zkrátí natolik, že se už jejich DNA nemůže
replikovat bez ztráty kódujících sekvencí.
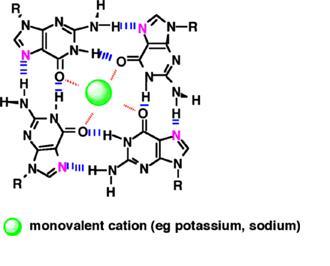
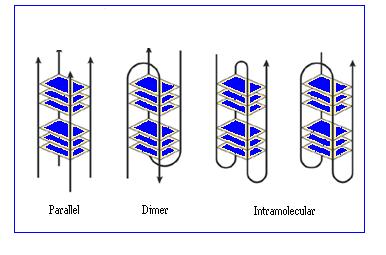
Obr. 1:
guaninový kvadruplex
Obr. 2: Struktura guaninového kvadruplexu
může zahrnovat pouze jedno nebo dvě telomerová zakončení řetězce DNA, která se
otáčejí zpět a vytváří smyčku, nebo je tvořena čtyřmi různými vlákny DNA. Ty se
spojují v různé kvadruplexové struktury. Zjistilo se, že v závislosti
na počtu různých vzájemně asociovaných DNA řetězců mohou vznikat jak paralelní,
tak i antiparalelní struktury. (URL
127)
Telomery také
chrání DNA před těmi molekulami v buňce, které rozpoznávají poškozenou
DNA, a brání tak zahájení procesu programované destrukce buňky (apoptózy).
Některé tkáně
obsahují telomerázy – speciální enzymy obsahující sekvence RNA, které využívají
jako templáty. Ttyto enzymy katalyzují vznik telomer použitím RNA templátu na
3´ konci chromozómů, takže 5´ konec může růst za pomoci DNA polymerázy a DNA
ligázy.
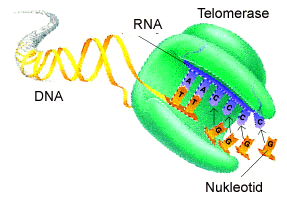
převzato z (URL 129 -
japonsky)
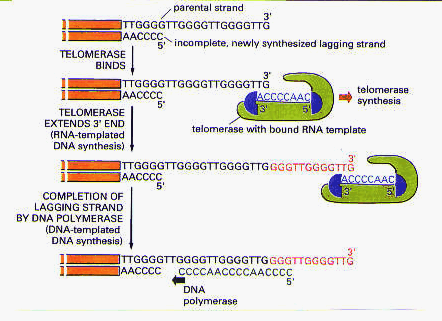
Replikace
telomer: obrázek ukazuje jak se tvoří telomerové opakující se a na G bohaté
sekvence (červeně), tvořící konce chromozómů. K replikaci telomer je
nezbytná telomeráza (světle zelená), což je komplex proteinu s templátem
RNA (modře). Po replikaci telomery může pokračovat syntéza DNA a vytváří se
nové vlákno DNA (tmavě zelené). Převzato z URL 130.
V lidském
organismu se běžně vyskytují telomerázy pouze ve tkáních produkujících pohlavní
buňky. Tím je zajištěno, že chromozómy zárodečných buněk mají dlouhé telomery.
Zkracování telomer (URL
132) ve tkáních je zřejmě jedním z faktorů způsobujících stárnutí
organismu. Nežádoucí přítomnost telomeráz se objevuje u některých rakovinných
buněk, takže jejich
rychlá
reprodukce nevede ke zkracování telomer a buněčné smrti z nedostatku
nezbytných genů.
Telomery
myši (světlé body na koncích chromozómů).
Převzato
z URL
128.
3.4.
3.4. Přehled
transkripce a translace
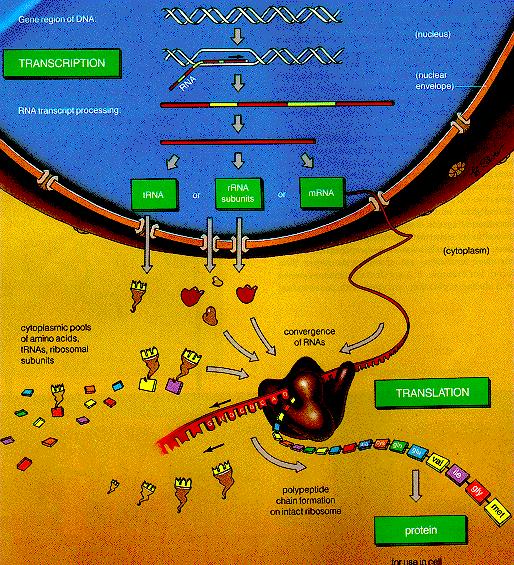
Převzato z URL 136
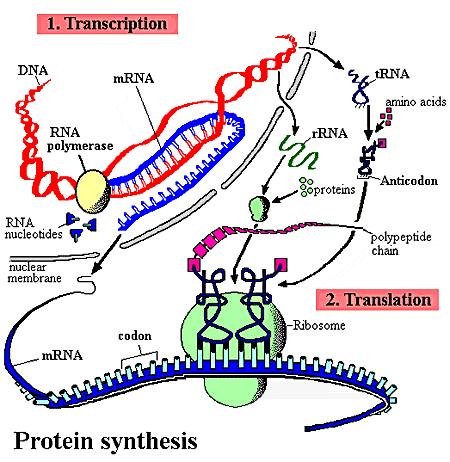
Převzato z URL 184 Viz též
černobílá verze URL
185.
1.
1. Geny
(DNA) se přepisují do RNA pomocí enzymu RNA polymerázy. Tento přepis řídí
-
- promotory
-
- regulační
proteiny
-
- stav
buňky (G1, G2, S atd.)
2. 2.
Transkripty DNA jsou jsou dále podrobovány posttranskripční úpravě
-
- rRNA
transkripty jsou rozsekány na třídy vhodné velikosti
-
- t-RNA
se skládají do určitých tvarů
-
- mRNA
transkripty získávají čepičku na 5´konci a ocas přidaný na 3´konec, z transkriptu se odstraňují nekódující
sekvence (introny).
-
- všechny
typy RNA se musí póry v jaderné membráně přemístit do cytoplazmy
3. 3.
Molekuly mRNA jsou překládány (translace) pomocí ribozómů (rRNA +
ribozomální proteiny), které přikládají kodony sestávající ze 3 bází ke 3 bázím
antikodonu odpovídajících molekul tRNA
-
- ribozómy
zahajují syntézu proteinů methioninem, k čemuž použijí první AUG kodon
-
- zpráva
se čte po 3 bázích současně, bez oddělení nebo překryvů
-
- mezi
sousedními aminokyselinami se tvoří peptidové vazby, čímž se vytváří rostoucí polypeptidový řetězec
-
- narazí-li
na „stop“ kodon (UAA, UGA, UAG), translace se zastaví
4. 4.
Nově syntetizované proteiny jsou často po translaci dále modifikovány
(post-translace)
-
- ve
spojení s chaperonovými proteiny (URL 144,), jejichž funkcí
je napomáhat jiným proteinům k dosažení správné terciální struktury,
probíhají u proteinů konečné konformační adaptace
-
- rozpustné
proteiny mohou mít připojen cukr
-
- sekreční
proteiny se musí syntetizovat přes membránu, během tohoto procesu se odstraní
počáteční část proteinu
-
- multimerní
proteiny se musí složit z příslušných podjednotek
-
- u
některé proteinů (např. insulin) se část proteinu odstraní
5. 5.
Každý protein se stává nositelem určité své specifické funkce
3.5.
DNA - RNA (transkripce) (URL
137, URL 139 - česky)
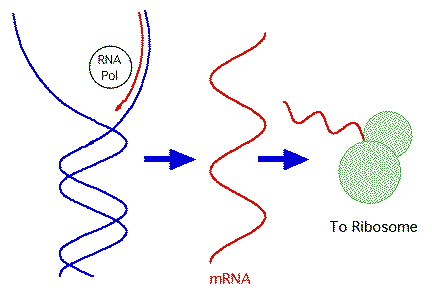
Na templátu DNA se syntetizuje molekula RNA:
1.
1.
RNA polymeráza otvírá dvoušroubovici DNA a připojuje k jednomu
z řetězců ribonukleotidy.
2.
2.
Po skončení syntézy se molekula RNA uvolní a
3.
3.
opouští jádro a putuje k ribozómu. (Tento typ RNA se nazývá
messengerová RNA (mRNA). Je vždy jednovláknová.)
Převzato
z URL
138
Průběh transkripce:
![]() Asi 50 různých trankripčních faktorů
bílkovinné povahy se váže na místo kde se nachází promotory (URL140),
což bývá obvykle 5´ konec přepisovaného genu.
Asi 50 různých trankripčních faktorů
bílkovinné povahy se váže na místo kde se nachází promotory (URL140),
což bývá obvykle 5´ konec přepisovaného genu.
![]() Ke komplexu transkripčních faktorů se váže
enzym RNA polymeráza.
Ke komplexu transkripčních faktorů se váže
enzym RNA polymeráza.
RNA polymerázy –
prokaryotní (URL
166) a eukaryotní (URL 167):
Eukaryotní RNA polymerázy:
-
- RNA polymeráza I (pol I) přepisuje do rRNA geny pro
prekurzory molekul 28S, 18S a5.8S (je to nejčastěji působící polymeráza)
-
- RNA polymeráza II (Pol II, též známá jako RNAP II) (URL 141).
Přepisuje geny kódující proteiny do mRNA (a též snRNA geny).
-
- RNA polymeráza III (Pol III). Přepisuje 5S rRNA geny
a všechny geny tRNA.
![]() Tento komplex transkripčních faktorů spolu
s RNA polymerázou otevírají dvoušroubovici DNA
Tento komplex transkripčních faktorů spolu
s RNA polymerázou otevírají dvoušroubovici DNA
![]() RNA polymeráza postupuje podél jednoho z
vláken dvoušroubovice ve směru od 3´ konce k 5´konci.
RNA polymeráza postupuje podél jednoho z
vláken dvoušroubovice ve směru od 3´ konce k 5´konci.
![]() Tento proces v eukaryotních buňkách
vyžaduje – přinejmenším u genů kódujících proteiny – odstranění nukleosomů před
postupující RNA polymerázou (RNAP II). Tento úkol plní určitý komplex proteinů.
Tentýž komplex opět po proběhlé transkripci DNA a odstranění RNAP II znovu
nukleosomy nahrazuje.
Tento proces v eukaryotních buňkách
vyžaduje – přinejmenším u genů kódujících proteiny – odstranění nukleosomů před
postupující RNA polymerázou (RNAP II). Tento úkol plní určitý komplex proteinů.
Tentýž komplex opět po proběhlé transkripci DNA a odstranění RNAP II znovu
nukleosomy nahrazuje.
![]() Během postupu RNA polymerázy podél vlákna DNA
se vytváří řetězec ribonukleotidů (URL
142) - ve formě trifosfátů, např. ATP - spojovaných do vlákna RNA.
Během postupu RNA polymerázy podél vlákna DNA
se vytváří řetězec ribonukleotidů (URL
142) - ve formě trifosfátů, např. ATP - spojovaných do vlákna RNA.
![]() Každý ribonukleotid se k rostoucímu
vláknu RNA připojuje podle pravidla o párování bazí (URL
143). Tak například na místě, kde se ve vláknu DNA nachází C, je k RNA
připojen G, kde je G, připojuje se C, a u T se připojuje A. Avšak na místě kde
je v DNA řetězci A se vkládá do RNA pyrimidin uracil (U, jako uridin
trifosfát UTP). V RNA se nenachází T, nahrazuje jej U.
Každý ribonukleotid se k rostoucímu
vláknu RNA připojuje podle pravidla o párování bazí (URL
143). Tak například na místě, kde se ve vláknu DNA nachází C, je k RNA
připojen G, kde je G, připojuje se C, a u T se připojuje A. Avšak na místě kde
je v DNA řetězci A se vkládá do RNA pyrimidin uracil (U, jako uridin
trifosfát UTP). V RNA se nenachází T, nahrazuje jej U.
![]() Syntéza RNA probíhá ve směru od 5´ k 3´ konci.
Syntéza RNA probíhá ve směru od 5´ k 3´ konci.
![]() Při připojování nukleosid trifosfátu na 3´
konec rostoucího RNA vlákna se dva koncové fosfáty odstraňují.
Při připojování nukleosid trifosfátu na 3´
konec rostoucího RNA vlákna se dva koncové fosfáty odstraňují.
![]() Když se RNA polymeráza setká
s terminačním signálem (tvořeným specifickou sekvencí nukleotidů), je
spolu se svým transkriptem uvolněna z DNA. Genom využívá mnoho různých
terminačních signálů.
Když se RNA polymeráza setká
s terminačním signálem (tvořeným specifickou sekvencí nukleotidů), je
spolu se svým transkriptem uvolněna z DNA. Genom využívá mnoho různých
terminačních signálů.
Jakékoliv
místo v molekule DNA, v kterémkoliv z obou vláken, může sloužit
jako templát . Z toho vyplývá že některé geny „probíhají“ jedním směrem
a jiné opačným. Avšak RNA postupuje
podél vlákna vždy ve směru od 3´ k 5´.
Výsledky publikované
v Nature v r. 2001 naznačují, že RNA polymeráza ve skutečnosti
sleduje stopu kolem dvoušroubovic DNA. In vitro, kdy je RNA polymeráza
imobilizována, otáčí během svého pohybu po molekule touto molekulou DNA stále
dokola. Jak je to ale in vivo, zda rotuje RNA polymeráza nebo DNA, zůstává
zatím neobjasněno.
Syntetizuje se několik
typů RNA:
RNA = ribonucleic acid -
kyselina ribonukleová. Její molekula je tvořena jen jedním (není zcela pravda,
existují i dvouřetězcové RNA, např. u některých virů) polynukleotidovým
vláknem. Sacharidovou složku tvoří 5C cukr D-ribosa, jako dusíkaté báze se zde
vyskytují adenin, cytosin, guanin a uracil (místo pyrimidinové báze thyminu).
Vyskytují se, kromě několika dalších, 3 základní typy RNA: mRNA, rRNA a tRNA:
|
|
![]() Informační neboli messengerová RNA (mRNA) – slouží ke translaci – vzniku polypeptidů
Informační neboli messengerová RNA (mRNA) – slouží ke translaci – vzniku polypeptidů
Informační RNA svým širokým rozsahem velikostí odráží
nejrůznější velikosti polypeptidů, které kóduje. Většina buněk produkuje malá
množství tisíců druhů různých molekul RNA, z nichž každá kóduje nějaký pro
buňku potřebný polypeptid. Mnohé molekuly mRNA se běžně vyskytují ve většině
buněk, protože kódují běžně se vyskytující bílkoviny (např. enzymy pro glykolýzu – URL
149). Další molekuly mRNA jsou specifické pouze pro určité typy buněk,
např. mRNA pro hemoglobin v prekurzorech červených krvinek.
![]() Ribosomální RNA (rRNA) – tvoří součást ribozómů, které pomocí translace mRNA
syntetizují bílkoviny. Podjednotky ribozómů se syntetizují v jadérku.
Nejdříve v jadérku vzniknou transkripcí pomocí RNA-polymerázy I vlákna
ribonukleoproteinu o velikosti 80S (S označuje Svedbergovu jednotku pro
sedimentační koeficient). Ty se štěpí na prekurzory dvou hlavních podjednotek
ribozómů o velikosti 20S a 32S a získávají tvar granulí. Jejich další úpravou
vznikají 18S, 28S a 5,8S RNA, které společně s proteinem vytváří malou
(40S) a velkou (60S) podjednotku ribozómu. Ty opouštějí jádro skrze jeho póry a
spojují se s mRNA a tRNA za účelem syntézy bílkovin.
Ribosomální RNA (rRNA) – tvoří součást ribozómů, které pomocí translace mRNA
syntetizují bílkoviny. Podjednotky ribozómů se syntetizují v jadérku.
Nejdříve v jadérku vzniknou transkripcí pomocí RNA-polymerázy I vlákna
ribonukleoproteinu o velikosti 80S (S označuje Svedbergovu jednotku pro
sedimentační koeficient). Ty se štěpí na prekurzory dvou hlavních podjednotek
ribozómů o velikosti 20S a 32S a získávají tvar granulí. Jejich další úpravou
vznikají 18S, 28S a 5,8S RNA, které společně s proteinem vytváří malou
(40S) a velkou (60S) podjednotku ribozómu. Ty opouštějí jádro skrze jeho póry a
spojují se s mRNA a tRNA za účelem syntézy bílkovin.
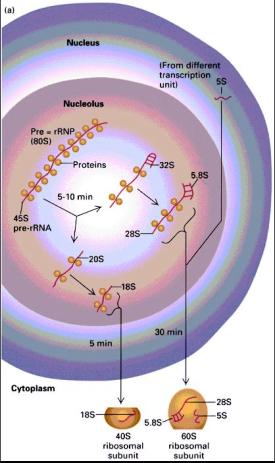
převzato
z www
Vyskytují
se ve čtyřech druzích. V eukaryotních buňkách to jsou
-
-
18S rRNA. Jedna tato molekula společně s asi 30ti různými molekulami
bílkovin tvoří menší podjednotku ribozómu.
-
-
28S, 5,8S a 5S rRNA. Tyto molekuly společně s 45 různými molekulami
bílkovin vytvářejí velkou podjednotku ribozómu.
Číslo S označující
jednotlivé typy rRNA charakterizuje rychlost sedimentace těchto molekul
v ultracentrifuze. Čím větší je toto číslo, tím větší je molekula (ale
nikoliv úměrně)
Zde
najdete obrázek ukazující transkripci v klastrech (shlucích) genů pro
rRNA): URL
151
![]() Transferová
RNA (tRNA) – molekuly této RNA
přenášejí aminokyseliny k rostoucímu polypeptidu
Transferová
RNA (tRNA) – molekuly této RNA
přenášejí aminokyseliny k rostoucímu polypeptidu
Typická
eukaryotní buňka obsahuje 32 různých
druhů tRNA:
-
-
každá z nich je produktem zvláštního genu
-
-
jsou malé (asi 4S), obsahují 73-93 nukleotidů
-
-
mnohé báze v řetězci se spolu navzájem párují a vytvářejí tím
dvouřetězcové úseky
-
-
nespárované oblasti tvoří 3 smyčky
-
-
každá RNA nese na svém 3´ konci jednu ze 20 aminokyselin (většině
aminokyselin odpoídá více než jedna tRNA)
-
-
na jedné ze smyček tvoří 3 nespárované báze antikodon.
-
-
párování bazí mezi antikodonem a komplementárním kodonem na molekule
mRNA připojuje spávnou aminokyselinu k rostoucímu polypeptidovému řetězci.
Podrobněji bude tento proces popsán v kapitole věnované translaci.
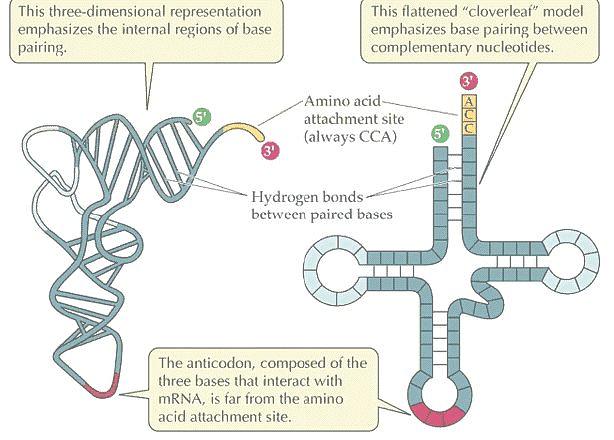
Převzato z URL 152. Viz též URL
150
![]() Krátká
jaderná RNA (snRNA –
obr. viz URL 153) –
Transkripce genů DNA pro mRNA, rRNA a tRNA vytváří velké molekuly prekurzorů
(primární transkripty), které musí být uvnitř jádra modifikovány tak, aby
vznikly funkční molekuly, které jsou pak exportovány do cytosolu. Některé stupně
tohoto procesu jsou zprostředkovávány působením molekul snRNA.
Krátká
jaderná RNA (snRNA –
obr. viz URL 153) –
Transkripce genů DNA pro mRNA, rRNA a tRNA vytváří velké molekuly prekurzorů
(primární transkripty), které musí být uvnitř jádra modifikovány tak, aby
vznikly funkční molekuly, které jsou pak exportovány do cytosolu. Některé stupně
tohoto procesu jsou zprostředkovávány působením molekul snRNA.
Bylo
identifikováno asi tucet různých genů pro molekuly snRNA, z nichž každý
existuje v mnoha kopiích. Tyto snRNA plní různé úkoly v procesu
tvorby jiných druhů RNA. Například některé snRNA tvoří součást splicesomu (URL
154), který se podílí na přeměně
pre-mRNA na mRNA vystřihnutím intronu a spojováním exonů. Viz URL
155.
![]() Krátké
RNA jadérka (snoRNA –URL
155) – nacházejí se uvnitř jadérka. Je jich něco přes 100 a plní
v jadérku několik funkcí:
Krátké
RNA jadérka (snoRNA –URL
155) – nacházejí se uvnitř jadérka. Je jich něco přes 100 a plní
v jadérku několik funkcí:
-
- Některé
se podílejí na tvorbě ribozómů tím, že pomáhají rozstříhat na menší části
prekurzory molekul 28S, 18S, and 5.8S.
-
- Jiné
v těchto molekulách chemicky modifikují mnohé nukleotidy např. přidáním
metylové skupiny k ribóze.
-
- Další
slouží jako templáty pro syntézu telomer.
U obratlovců jsou snoRNA
vytvořeny z intronů odstraněných v průběhu vytváření molekul RNA.
![]() Mikro
RNA (miRNA – URL 156)
– jsou velmi krátké (asi 22 nukleotidových sekvencí) RNA molekuly . Zdá se, že
regulují expresi molekul mRNA.
Mikro
RNA (miRNA – URL 156)
– jsou velmi krátké (asi 22 nukleotidových sekvencí) RNA molekuly . Zdá se, že
regulují expresi molekul mRNA.
![]() XIST
RNA (URL
148) – inaktivuje jeden ze dvou chromozómů u obratlovců samičího pohlaví.
XIST
RNA (URL
148) – inaktivuje jeden ze dvou chromozómů u obratlovců samičího pohlaví.
Antisense RNA: (URL 164 – česky, URL 165)
Jde o uměle připravenou
RNA, sloužící k blokování vybraného genu. Syntetizovaný řetězec antisense RNA
má pořadí nukleotidů komplementární k úseku mediátorové RNA vytvořené
dotyčným genem, takže s ním vytvoří dvoušroubovicovou strukturu. RNA potom nemůže sloužit k translaci.
Tímto způsobem byla objevena tzv. RNA interference.
3.6.
Translace
je proces, kterým se přepisuje genetická informace
z kodonů mRNA do specifické sekvence aminokyselin v proteinu. Na mRNA
se připojí skupina ribozómů, čímž vznikne struktura zvaná polyzóm.
Komplementární antikodon tRNA s připojenou aminokyselinou se připojí na
první kodon mRNA, a následně si další kodon k sobě stejným způsobem připojí
svůj komplementární antikodon s aminokyselinou. Ribozóm zde působí jako
jakýsi rám, který drží mRNA a tRNA pohromadě do té doby, než se k druhé
aminokyselině připojí ještě třetí. Tímto způsobem vzniká připojováním dalších
aminokyselin polypeptidový řetězec.
Za prvním ribozómem mohou podél mRNA bezprostředně
následovat další, takže se identické molekuly polypeptidu tvoří současně.
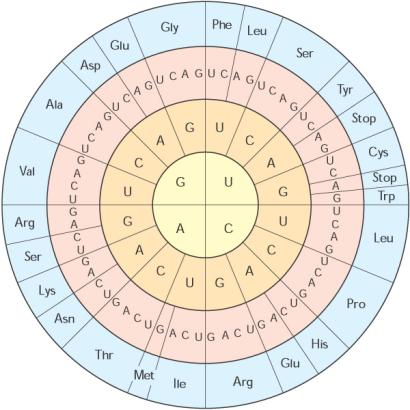
Převzato z URL
158
Přepis mRNA do proteinu – z „jazyka“ nukleových kyselin do „jazyka“ bílkovin
(URL
159).
1.
1.
Každá skupina tří nukleotidů
v nukleové kyselině tvoří kodon, který reprezentuje informaci značící
určitou aminokyselinu
2.
2.
Tato aminokyselina tvoří stavební
jednotku proteinu
3.
3.
Existují kodony pro začátek a konec
bílkovinného řetězce
Průběh translace:
1.
1.
K ribozómu se připojuje mRNA a
přečte první kodon
2.
2.
Přenosová RNA (tRNA) přináší
k ribozómu správnou aminokyselinu a uvolní ji
3.
3.
Ribozóm přejde k dalšímu kodonu a
další tRNA přináší další aminokyselinu
4.
4.
Aminokyseliny se vzájemně spojují peptidickými vazbami a
tvoří rostoucí řetězec polypeptidu či bílkovinné molekuly.
5.
5.
Přejde-li ribozóm ke STOP kodonu,
polypeptidový řetězec se uvolní a mRNA odpadne od ribozómu
Příklad: AUG (kód methioninu) ![]() tRNA
k ribozómu methionin
tRNA
k ribozómu methionin
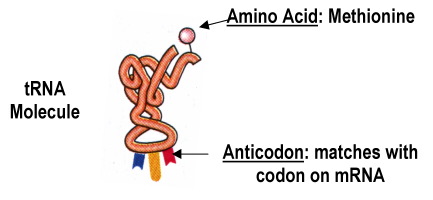
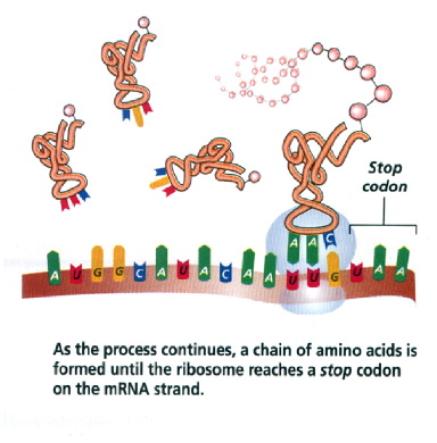
převzato z www
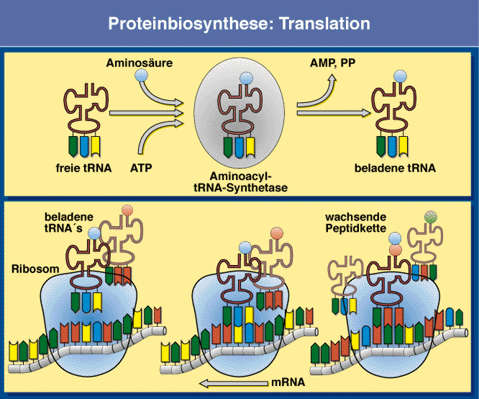
Převzato z www
3.7.
3.7. Struktura ribozómů (URL
161)
Struktura
ribozómu. Převzato z URL
162
Jsou to malé organely,
složené z malé a velké podjednotky (URL 163). Každá podjednotka je
tvořena ribozomální RNA (rRNA) a proteinem. Nacházejí se v buňkách
prokaryot i eukaryot – na povrchu endoplasmatického retikula (URL 160), často
spojené vláknem mRNA do polyribozómů, nebo jako tzv. polysomy volně
v cytoplazmě. Poněkud menší ribozómy se nacházejí i v mitochondriích
(URL
195) a chloroplastech, což naznačuje že tyto byly původně samostatnými
organismy. Plní při syntéze bílkovin následující funkce:
1. 1.
Poskytují prostor pro setkání mRNA a tRNA
2. 2.
Katalyzují v rostoucím řetězci aminokyselin tvorbu peptidické vazby
3 3
Zajišťují správné místo pro počátek a konec peptidického řetězce
|
Ribosomes
consist of 3 and 4 RNAs and 52 and 83 proteins. |
|
|
|
|
|
Each
ribosome consists of a large and small subunit. The large subunit proteins
are named L1, L2 etc. and
the small subunits are S1, S2, etc. |
Převzato z www
Použitá literatura
1.
1. Alberts
B. a kol. Základy buněčné biologie (Essential Cell Biology, 1998, Garland
Publishing, NY 10022, USA), České vydání - Espero publishing, Ústí n. L.
2.
2. Nečas,
O. a kol.:Obecná biologie pro lékařské fakulty. H&H Vyšehradská, Jinočany
2000
3.
3. Knoz,
J.: Obecná zoologie I. Skripta přírodověd. Fak. UJEP, 1979
4.
4. Kubišta,
V.: Buněčné základy životních dějů. Scientia, Praha 1998
5.
5. Koblížek,
M., Prášil, O.: Fototrofní bakterie, Vesmír 81, č. 9 (2002), str. 505
6.
6. Rosypal a kol.: Přehled biologie. - Scientia spol. s
r. o., 1994, II. uprav. vydání.
7.
7. Storchová, Z.: O buněčném odpadu, Vesmír 84, č. 2
(2005), str. 73
8.
8. Patočka, J.: Tunelující nanotrubičky – nový způsob
komunikace buněk. Vesmír 85, str. 319 (červen 2006)
Použité
www stránky
1.
1.
http://fig.cox.miami.edu/~cmallery/150/unity/cell.text.htm
2.
2.
http://www.visioneng.com/technology/microscope_history.htm
3.
3.
http://oldwww.upol.cz/resources/ktf/joch/huvod/galileo.html
4.
4.
http://sweb.cz/galerie2/lm/purkyne.htm
5.
5.
http://www.ucmp.berkeley.edu/history/leeuwenhoek.html
6.
6.
http://scienceworld.wolfram.com/biography/Schleiden.html
7.
7.
http://www.newadvent.org/cathen/13592b.htm
8.
8.
http://www.microscopy-uk.org.uk/mag/artmar00/hooke1.html
9.
9.
http://neurolab.jsc.nasa.gov/purkinje.htm
10. 10.
http://www.img.cas.cz/paces/Genomika_2000.htm
11. 11.
http://www.vet.ksu.edu/depts/dmp/personnel/faculty/virchowbioe.htm
12. 12.
http://www.paru.cas.cz/lem/book/index
13. 13.
http://archive.uwcm.ac.uk/uwcm/medmicsci/emfirst.html
14. 14.
http://www.cellsalive.com/index.htm
15. 15.
http://www.wou.edu/las/natsci_math/biology/boomer/Bio440/emerging2002/mccallister/PRION1.html
16. 16.
http://www.kcom.edu/faculty/chamberlain/Website/Lects/PRIONS.HTM#educ
17. 17.
http://web.redbox.cz/gebauer/bse/prenos.htm
18. 18.
http://www.mad-cow.org/~tom/prion_structure_folder/gallery.html
19. 19.
http://faculty.une.edu/cas/mjohnson/MICRO/Virus%20web%20pages/Armida%20virus/prion.html
20. 20.
http://www.immaculata.edu/bioinformatics/ekramer/PRION%20PROJECT%20BODY.htm
21. 21.
http://bloodyred88.tripod.com/id2.html
22. 22.
http://www.kauf.cz/ascii/include/textova_reklama/vesely/biologie_2.php
23. 23.
http://www.mpiz-koeln.mpg.de/~rohde/randles.html
24. 24.
http://wilkes1.wilkes.edu/~terzaghi/BIO-226/lectures/03.html
25. 25.
http://enews.lbl.gov/Science-Articles/Archive/infectCells.html
26. 26.
http://www.radekvesely.cz/knihybig/bbiotext.htm#vr
27. 27.
http://www.mun.ca/biology/scarr/4241/TKAMgenetics.html
28. 28.
http://www.nature.com/genomics/human/watson-crick/
29. 29.
http://www.time.com/time/time100/scientist/profile/watsoncrick.html
30. 30.
http://www.nobel.se/medicine/laureates/1965/monod-bio.html
31. 31.
http://www.nobel.se/medicine/laureates/1969/delbruck-bio.html
32. 32.
http://ambafrance-ca.org/HYPERLAB/PEOPLE/_pasteur.html
33. 33.
http://www.nobel.se/medicine/laureates/1905/koch-bio.html
34. 34.
http://www.nobel.se/medicine/laureates/1908/index.html
35. 35.
http://darwin.wz.cz/darwin.htm
36. 36.
http://www.mendelu.cz/univerzita/mendel.html
37. 37.
http://www.virology.net/ATVimages.html
38. 38.
http://hiv.buffalo.edu/hivlifecycle.shtml
39. 39.
http://www.vesmir.cz/11_97/612.html
40. 40.
http://www.emc.maricopa.edu/faculty/farabee/BIOBK/BioBookmito.html
41. 41.
http://www-ext.rozhlas.cz/veda/portal/_zprava/24399
42. 42.
http://project.bio.iastate.edu/Courses/MIPM302/302new/1_3procaryote.html
43. 43.
http://www.cellsalive.com/cells/bactcell.htm
44. 44.
http://www.brunel.ac.uk/depts/bl/project/microbio/cellstrc/bacwall/peptidog.htm
45. 45.
http://www.sciencenet.com.au/frames/profiles/positive/f_posit.htm
46. 46.
http://www.sciencenet.com.au/frames/profiles/negative/f_negat.htm
47. 47.
http://www.arches.uga.edu/~kristenc/cellwall.html
48. 48.
http://academic.pg.cc.md.us/~kroberts/lecture/lecture/chapt4/meso.htm
49. 49.
http://biology.about.com/cs/cellbiology/
50. 50.
http://biologie.upol.cz/
51. 51.
http://www.accessexcellence.org/WN/SU/marg499.html
52. 52.
http://omega.dawsoncollege.qc.ca/ray/cell/401cell.htm
53. 53.
http://www.vesmir.cz/05_2000/250.htm
54. 54.
http://www.biotox.cz/toxikon/bakterie/bakterie/escherichia_coli.htm
55. 55.
http://www.cvm.uiuc.edu/vetreport/summer2000/malaria.html
56. 56.
http://www.bact.wisc.edu/Bact303/Structure
57. 57.
http://www.prozyme.com/technical/pbvrwdata.html
58. 58.
http://planta.aquariana.cz/rasy_01.htm
59. 59.
http://www.biotox.cz/naturstoff/biologie/bi-sinicerasy.html
60. 60.
http://www.biotox.cz/toxikon/sinice/uvod.htm
61. 61.
http://nai.arc.nasa.gov/news_stories/news_detail.cfm?article=carbon.cfm
62. 62.
http://www.cat.cc.md.us/courses/bio141/lecguide/unit1/3domain/3domain.html
63. 63.
http://omega.dawsoncollege.qc.ca/ray/cell/401cell.htm
64. 64.
http://biology.sherman.udayton.edu/HomeStudy/cells-med.htm
65. 65.
http://dragon.seowon.ac.kr/~bioedu/bio/ch04.htm
66. 66.
http://www.zdravcentra.cz/?act=k-10&did=337
67. 67.
http://amoeba.ifmo.ru/guide.htm
68. 68.
http://emu-logic.tooraweenah.com/products/eggs.phtml
69. 69.
http://vydavatelstvi.vscht.cz/knihy/uid_es-001/motor/index.CS.html
70. 70.
http://sun.menloschool.org/~cweaver/cells/c/cell_membrane/
71. 71.
http://telstar.ote.cmu.edu/Hughes/tutorial/cellmembranes/
72. 72.
http://www.uni-mainz.de/FB/Medizin/Anatomie/workshop/EM/Schemazell.html
73. 73.
http://www.biologie.hu-berlin.de/~molbp/new/lipid/main.htm
75. 75.
http://www.colorado.edu/MCDB/MCDB1150/ohd/overhead.html
76. 76.
http://www.sirinet.net/~jgjohnso/biologyI.html
77. 77.
http://ghs.gresham.k12.or.us/science/ps/sci/ibbio/cells/notes/ch5/plant.htm
78. 78.
http://www.cellsalive.com/cells/centriol.htm
79. 79.
http://www.uchsc.edu/cdb/faculty/selitrennikoff.htm
80. 80.
http://online-media.uni-marburg.de/histologie/introhis/HIS/txt/ctbo/ctbo03.htm
81. 81.
http://www.cs.wright.edu/~dkender/bme422/transprt.htm
82. 82.
http://www.licor.com/bio/Posters/App_529/A529_TransA.jsp
83. 83.
http://www.bio.utk.edu/kennedy/Mitoreadings421.htm
84. 84.
http://srs.dl.ac.uk/Annual_Reports/AnRep02_03/escort.htm
85. 85.
http://fig.cox.miami.edu/Faculty/Dana/104F01_9print.html
86. 86.
http://projects.edtech.sandi.net/miramesa/Organelles/lyso.html
87. 87.
http://www.biologie.uni-hamburg.de/b-online/e04/04a.htm
88. 88.
http://atlases.muni.cz/atl_cz/main+nenadory+cizmat.html#hemosiderin
89. 89.
http://www.proweb.org/kinesin/Pigment_aggregation.html
90. 90.
http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/E/Endoreplication.html
91. 91.
http://fig.cox.miami.edu/Faculty/Dana/105F00_4.html
92. 92.
http://www.cneccc.edu.hk/subjects/bio/album/Chapter3/index.html
93. 93.
http://www.vc.cc.tx.us/dept/bio/Mitosis/index.htm
94. 94.
http://www.albany.edu/~abio304/text/8part1.html
95. 95.
http://info.med.yale.edu/genetics/ashley/text/pictures/
96. 96.
http://anatomy.iupui.edu/courses/histo_D502/D502f04/lecture.f04/cell.f04/cellf04.html.html
97. 97.
http://distance.stcc.edu/AandP/AP/AP2pages/reprod/oogenesi.htm
98. 98.
http://www.uic.edu/classes/bios/bios100/lecturesf04am/lect16.htm
99. 99.
http://www.johnkyrk.com/DNAanatomy.html
100. 100. http://www.biology.arizona.edu/Cell_bio/tutorials/cell_cycle/cells3.html
101. 101. http://www.stanford.edu/group/fanglab/science/research_cycle.html
102. 102. http://www.uoguelph.ca/zoology/devobio/210labs/cellcycl.htm
103. 103. http://www.tiem.utk.edu/~gross/bioed/webmodules/mitoticindex.htm
104. 104. http://www.pitt.edu/~biohome/Dept/Frame/Faculty/Saunders.htm
105. 105. http://gapp.gen.gu.se/SearchVisual.php
106. 106. http://www.spiralnotebook.org/ingraphicdetail/index.html
107. 107. http://gslc.genetics.utah.edu/units/disorders/karyotype/chrompictures.cfm
108. http://courses.cm.utexas.edu/emarcotte/ch339k/fall2005/FinalReview.html
109. 109. http://web.mit.edu/esgbio/www/dogma/repl.html
110. 110. http://www.inrp.fr/Acces/biotic/genetic/adn/html/points3.htm
111. 111. http://news.bbc.co.uk/1/hi/sci/tech/4355355.stm
112. 112. http://library.thinkquest.org/C0123260/basic%20knowledge/DNA.htm
113. 113. http://www.uic.edu/classes/phys/phys461/phys450/ANJUM04/
114. 114. http://cmgm.stanford.edu/biochem/biochem201/Slides/Chromatin%20Structure/
115. 115. http://faculty.ccbcmd.edu/biotutorials/dna/dna.html
116. 116. http://biol.lf1.cuni.cz/ucebnice/nemendelovska_dedicnost.htm
117. 117. http://www.biopticka.cz/sluzby/molekularni-genetika/vyzkum-mtDNA.html
118. 118. http://artsci.wustl.edu/~landc/html/cann/
119. 119. http://www.cytochemistry.net/cell-biology/mitochondria_lifecycle_graduate.htm
120. 120. http://www.cellsalive.com/cells/3dcell.htm
121. 121. http://web.indstate.edu/thcme/mwking/dna.html
122. 122. http://herkules.oulu.fi/isbn9514265815/html/i275971.html
123. 123. http://www.ndsu.nodak.edu/instruct/mcclean/plsc431/eukarychrom/eukaryo2.htm
124. 124. http://bioteach.ubc.ca/TeachingResources/MolecularBiology/DNAReplication.html
125. 125. http://herkules.oulu.fi/isbn9514265815/html/i276224.html
126. 126. http://oak.cats.ohiou.edu/~ballardh/pbio475/Heredity/Heredity.htm
127. 127. http://www.ch.ic.ac.uk/local/projects/burgoine/FightCancer.txt.html
128. 128. http://www.ibp.cz/labs/LDMC/publicinfo.php
129. 129. http://www.nyu.edu/classes/ytchang/book/c001.html
130. 130. http://chemcases.com/cisplat/cisplat20.htm
131. 131. http://www.linkos.cz/vzdelavani/3_99/1.php
132. 132. http://mil.citrus.cc.ca.us/cat2courses/bio104/ChapterNotes/Chapter08notesLewis.htm
133. 133. http://www.biotox.cz/toxikon/bakterie/bakterie/escherichia_coli.htm
134. 134. http://www.bcbp.gu.se/simonsson/tsaging.html
135. 135. http://bssv01.lancs.ac.uk/ADS/BIOS336/336L5.html
136. 136. http://members.aol.com/SHinrichs9/descent/descent.htm
137. 137. http://fajerpc.magnet.fsu.edu/Education/2010/Lectures/26_DNA_Transcription.htm
138. 138. http://www.duke.edu/web/MAT/jennifer_sohn/unit/transcription_oh.htm
139. 139. http://genetika.wz.cz/transk.htm
140. 140. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/P/Promoter.html
141. 141. http://www-als.lbl.gov/als/science/sci_archive/polymerase2.html
142. 142. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/N/Nucleotides.html
143. 143. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/B/BasePairing.html
144. 144. http://www.chaperone.sote.hu/Examples.html
145. 145. http://www.cod.edu/people/faculty/fancher/ProkEuk.htm
146. 146. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/T/snrna
147. 147. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/S/SexChromosomes.html#mechanism
148. 148. http://www.eurekah.com/abstract.php?chapid=1264&bookid=68&catid=54
149. 149. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/G/Glycolysis.html
150. 150. http://www.geneticengineering.org/chemis/Chemis-NucleicAcid/RNA.htm
151. 151. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/R/rDNA.html
152. 152. http://universe-review.ca/option2.htm
153. 153. http://www.aw-bc.com/mathews/ch28/fi28p31.htm
154. 154. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/R/Ribozymes.html#The_Spliceosome
155. 155. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/T/Transcription.html#snrna
156. 156. http://www.ambion.com/techlib/resources/miRNA/mirna_gen.html
157. 157. http://www.chemheritage.org/classroom/chemach/pharmaceuticals/watson-crick.html
158. 158. http://www.nicksnowden.net/Module_1_pages/nucleic_acids%20and%20protein_synthesis.htm
159. 159. http://138.192.68.68/bio/Courses/biochem2/GeneIntro/TranscriptionTranslation.html
160. 160. http://cellbio.utmb.edu/cellbio/ribosome.htm
161. 161. http://www.cs.stedwards.edu/chem/Chemistry/CHEM43/CHEM43/Ribosomes/Ribosome.HTML
162. 162. http://www.med.uottawa.ca/patho/devel/
163. 163. http://en.wikipedia.org/wiki/Ribosome
164. 164. http://www.osel.cz/index.php?clanek=233
165. 165. http://www.bioteach.ubc.ca/MolecularBiology/AntisenseRNA/
166. 166. http://www.herts.ac.uk/natsci/Bio/PPS/rnapolp.htm
167. 167. http://www.herts.ac.uk/natsci/Bio/PPS/rnapole.htm
168. 168. http://www.cas.muohio.edu/~wilsonkg/bot203/W_and_C/basic_proteins/histone/histone.htm
169. 169. http://arbl.cvmbs.colostate.edu/hbooks/genetics/medgen/chromo/chromosomes.html
170. 170. http://arbl.cvmbs.colostate.edu/hbooks/genetics/medgen/chromo/cytotech.html
171. 171. http://mil.citrus.cc.ca.us/cat2courses/bio104/ChapterNotes/Chapter08notesLewis.htm
172. 172. http://fig.cox.miami.edu/~cmallery/150/cells/proteasome.htm
173. 173. http://www.mdc-berlin.de/sommer/research.html
174. 174. http://delphi.phys.univ-tours.fr/Prolysis/microprot.html
175. 175. http://focus.hms.harvard.edu/2004/Oct29_2004/structural_biology.html
176. 176. http://www.virology.net/Big_Virology/BVHomePage.html
177. 177. http://physioweb.med.uvm.edu/bodyfluids/membrane.htm
178. 178. http://wappingersschools.org/RCK/staff/teacherhp/johnson/visualvocab/page4.html
179. 179. http://www.zoology.ubc.ca/~berger/B200sample/unit_8_protein_processing/clathrin_pits.htm
180. 180. http://www.ub.es/biocel/wbc/biocel/matrices_clatrina.htm
181. 181. http://focus.hms.harvard.edu/1998/Nov13_1998/complete.html
182. 182. http://www.daviddarling.info/encyclopedia/P/pinocytosis.html
183. 183. http://www.mcld.co.uk/hiv/?q=syncytia
184. 184. http://members.tripod.com/beckysroom/pictures3.htm
185. 185. http://www.emc.maricopa.edu/faculty/farabee/BIOBK/BioBookPROTSYn.html
186. 186. http://adamcribbs.tripod.com/page1.html
187. 187. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/C/Cytoskeleton.html
188. 188. http://www.cytochemistry.net/Cell-biology/intermediate_filaments.htm
189. 189. http://137.222.110.150/calnet/cellbio/page3.htm
190. 190. http://www.mun.ca/biology/scarr/4241/TKAMgenetics.html
191. 191. http://www.foresight.org/Updates/Update48/Update48.3.html
192. 192. http://www.biochem.northwestern.edu/holmgren/Glossary/Definitions/Def-S/scaffold_protein.html
193. 193. http://nai.arc.nasa.gov/news_stories/news_detail.cfm?article=carbon.cfm
194. 194. http://oolala9.tripod.com/
195. 195. http://www.icube-t.co.jp/orcs2001/past/abstruct/plenary2.html
196
196
http://scienceworld.wolfram.com/biography/Schleiden.html
197
197
http://www.newadvent.org/cathen/13592b.htm
198
198
http://ambafrance-ca.org/HYPERLAB/PEOPLE/_pasteur.html
199
199
http://nobelprize.org/nobel_prizes/medicine/laureates/1905/koch-bio.html
200
200
http://nobelprize.org/nobel_prizes/medicine/laureates/1908/mechnikov-bio.html
201
201
http://nobelprize.org/nobel_prizes/medicine/laureates/1908/ehrlich-bio.html
202
202
http://www.vet.ksu.edu/depts/dmp/personnel/faculty/virchowbioe.htm
203
203
http://www.libri.cz/databaze/kdo20/list.php?od=v&start=1
204
204
http://www.comms.dcu.ie/sheehanh/haldane.htm
205
205
http://www.quido.cz/osobnosti/darwin.htm
206
206
http://www.jgmendel.wz.cz/jgmendel.htm
207
196
http://www.dpma.de/infos/galerie/erfindergalerie/e_mikroskop.html
208
197
http://nobelprize.org/nobel_prizes/medicine/laureates/1969/delbruck-bio.html
209
198
http://nobelprize.org/nobel_prizes/medicine/laureates/1965/monod-bio.html
210
199
http://cs.wikipedia.org/wiki/Prion
211
200
http://www.wou.edu/las/natsci_math/biology/boomer/Bio440/emerging2002/mccallister/PRION1.html
212
201
http://www.kcom.edu/faculty/chamberlain/Website/Lects/PRIONS.HTM#educ
213
202
http://www.virology.net/ATVimages.html
214
203
http://www.life.umd.edu/classroom/bsci424/BSCI223WebSiteFiles/ProkaryoticvsEukaryotic.htm
215
204
http://textbookofbacteriology.net/structure.html
216
205
http://www-ext.rozhlas.cz/veda/portal/_zprava/24399
217
206
http://www.biotox.cz/toxikon/sinice/uvod.htm
218
207
http://www.cellsalive.com/cells/bactcell.htm
219
208
http://micro.magnet.fsu.edu/cells/bacteriacell.html
220
209
http://www.rockefeller.edu/vaf/capsule.htm
221
210
http://www.life.umd.edu/classroom/bsci424/BSCI223WebSiteFiles/GramPosvsGramNeg.htm
222
211
http://student.ccbcmd.edu/~gkaiser/biounits.html
223
212
http://www.accessexcellence.org/WN/SU/marg499.html
224
213
http://www.sinicearasy.cz/pages/pro-vsechny
225
214
http://www.jbc.org/cgi/content/full/278/32/29971
226
215
http://www.prozyme.com/technical/pbvrwdata.html
227
216
http://en.wikipedia.org/wiki/Cytoskeleton
228
217
http://toxicology.emtrading.cz/modules.php?name=News&file=article&sid=39
229
218
http://www.jimmunol.org/cgi/content/full/173/3/1511
230
219
http://www.nbio.uni-heidelberg.de/Groups/WWW_Gerdes/tnt.html
231
220
http://www.nature.com/nrm/journal/v2/n9/slideshow/nrm0901_688a_F1.html
232
221
233
222
Související www stránky k detailnímu
studiu:
Elektronová
mikroskopie pro biology
http://www.paru.cas.cz/lem/book/index.html#
http://www.cellsalive.com/index.htm
http://home.earthlink.net/~dayvdanls/lecw4cells1.html
http://www.mendelu.cz/af/fyziologie/cytologie/cytologie.htm
http://personal.tmlp.com/Jimr57/textbook/chapter3/chapter3.htm
http://www-cyanosite.bio.purdue.edu/images/images.html
http://mujweb.atlas.cz/veda/mitochondrie/
http://web.uct.ac.za/depts/mmi/stannard/linda.html
The WWW Virtual Library of Cell
Biology
http://vlib.org/Science/Cell_Biology/
http://www.emc.maricopa.edu/faculty/farabee/BIOBK/BioBooktransp.html
What is a
Cell?
http://www.ncbi.nlm.nih.gov/About/primer/genetics_cell.html
http://www.rkm.com.au/imagelibrary/index.html
HISTOLOGY
FULL-TEXT - prezentace
http://wberesford.hsc.wvu.edu/histol.htm#CYTOLOGY%20I
http://www.umanitoba.ca/faculties/afs/plant_science/COURSES/CYTO/l02/l02.2.html
Cytoskelet
- česká prezentace
http://www.med.muni.cz/biologie/prednasky/800x600/Cytoskelet.htm
Elektronenmikroskopischer
Atlas im Internet
http://www.uni-mainz.de/FB/Medizin/Anatomie/workshop/EM/Schemazell.html
Gallery of
invertebrate microphotography
http://www.uochb.cas.cz/~natur/microphoto/micro.htm
Další užitečné odkazy z kapitoly o struktuře
DNA:
Základy
genetiky (česky): http://genetika.wz.cz/
Transkripce
a translace genů – obrázek: http://gslc.genetics.utah.edu/units/basics/transcribe/
Animace
transkripce: http://www.johnkyrk.com/DNAtranscription.html
Funkce
DNA – od DNA k proteinu: http://www.qeced.net/bio/genbio/DNARNA.htm
Transkripce
a translace: http://www.uleth.ca/bio/sc1000/trans.html
Replikace,
transkripce a translace (prezentace): http://www.covingtonlatin.org/faculty/DNA%20SLIDES%20HIGH%20SCHOOL/Thumb.html
Nadbytečná
DNA: http://www.psrast.org/junkdna.htm
Syntéza
bílkovin: http://www.solutionsinhand.com/romy/Transcription-translation.html
Translace:
http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/T/Translation.html
Transkripce,
typy RNA, RNA polymerázy: http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/T/Transcription.html
Transkripce
a translace in vitro: http://www.the-scientist.com/yr2003/oct/lcprofile_031020.html
odkazy:
http://dir.niehs.nih.gov/dirlmg/repl.html
Replikace
DNA - odkazy: http://www.covingtonlatin.org/faculty/dna_sites.htm
Transripční
faktory: http://www.bionet.nsc.ru/bgrs/thesis/53/index.html
Kurs "buněčná a molekulární biologie": lf3.cuni.cz/studium/materialy/modul1b/zimni_semestr_03.doc
Prezentace:
http://alfa.bigy.cz/~orko/Replikacetranskripcetranslace_soubory/frame.htm
DNA
a mikrosatelity (J.Kypr): http://www.vesmir.cz/06_99/328.htm
Řízení
exprese genů: http://www.csu.edu.au/faculty/health/biomed/subjects/molbol/gene.htm
Molekulárně
biologická pohádka: http://prfdec.natur.cuni.cz/~krlcha/dnapoha.htm