Výzkumné zaměření LABIFEL
Výzkum Laboratoří biofyzikální chemie a bioelektrochemie ( LABIFEL) je orientován na studium elektrochemických transformací biologicky a medicínsky významných látek (oligonukleotidů, nukleových kyselin, proteinů a jejich fragmentů) v roztocích a na nabitých fázových rozhraních pomocí spektrálních a elektrochemických metod. Pochopení redoxních a adsorpčních mechanismů studovaných biomolekul dává možnost sofistikovaně vyvíjet elektrochemické senzory (biosenzory) s použitím nových elektrodových materiálů (nanočástice, nanokompozit, polymer) a rozvíjet nové elektrochemické procedury. Ve výzkumu (molekulární elektrochemie) spolupracujeme s Ústavem fyzikální chemie J. Heyrovského v Praze a ve výzkumu (elektrochemických senzorů) spolupracujeme se skupinou doc. Petra Skládala. Využíváme excelentní zařízení CEITEC-MU, zahrnující nukleární a paramagnetickou rezonanci (NMR a EPR), hmotnostní spektrometrii (MS), atomovou silovou mikroskopii (AFM) a skenovací elektronovou mikroskopii (SEM). Poslední dvě metody jsou užitečné pro studium morfologie elektrodových povrchů; s nimi, včetně těch dalších i s jejich bioaplikacemi, se lze seznámit v kurzech (C5855, C5856).
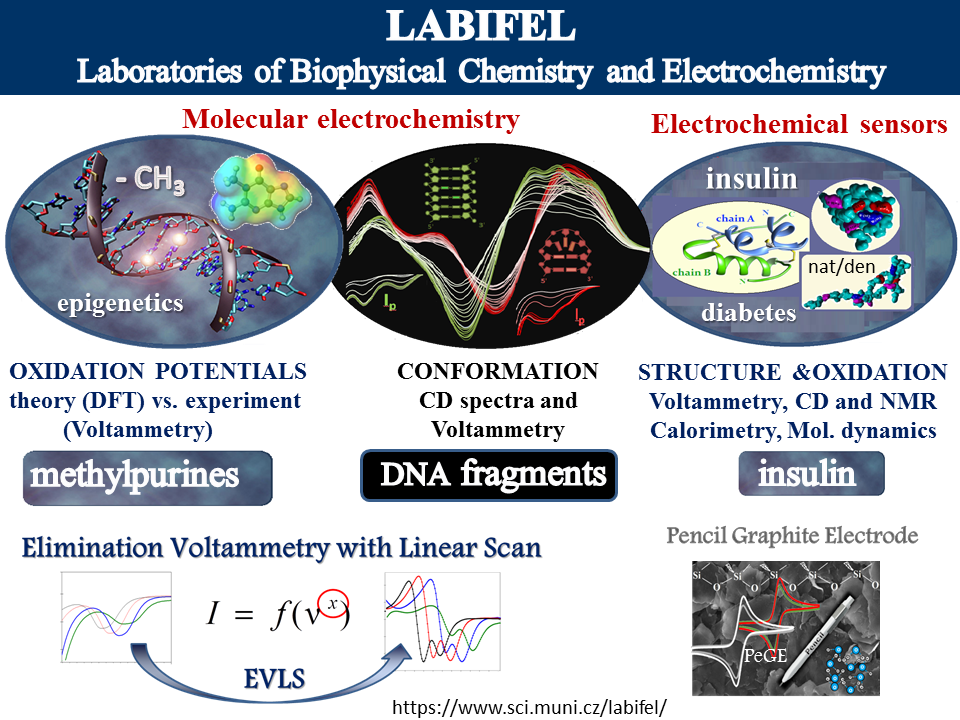
Anodický signál guaninu jako indikátor struktury DNA fragmentů a jejich interakcí
Pracoviště se dlouhodobě orientuje na elektrochemii nukleových kyselin (NK) a jejich složek. Mezi významnou prioritu patří objev a objasnění oxidačního signálu guaninu (G pík) na visící rtuťové elektrodě. Bylo zjištěno, že anodický signál guaninu odpovídá oxidaci jeho redukčního produktu, vznikajícího ve značně negativních potenciálech, kde dochází i k vývinu vodíku. Redukční produkt guaninu a jeho struktura byla potvrzena NMR spektroskopií. G pík je citlivým indikátorem strukturních změn oligonukleotidů (ODN) a dává možnost nejen velmi rychle rozlišit DNA od RNA oligonukleotid, ale i sledovat interakci fragmentů nukleových kyselin s léčivem, s ionty solí nebo se složkami pufrů.
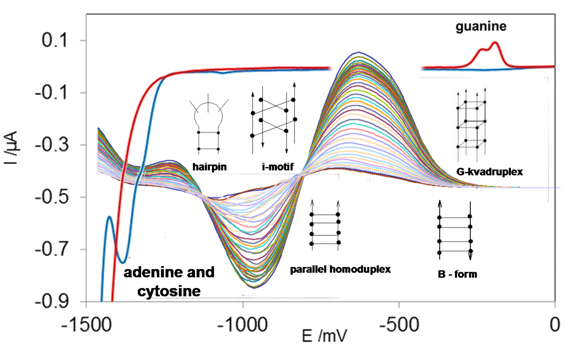
Eliminační voltametrie jako sensitivní a selektivní elektroanalytická metoda
 Na pracovišti je intenzivně rozvíjena nová elektrochemická metoda – eliminační voltametrie. Jedná se o metodu, která je ve voltametrii schopna některé dílčí proudy eliminovat a jiné zachovávat a tím zvyšovat citlivost i selektivnost voltametrických technik. Dříve nesla naše metoda název EVLS jako Elimination Voltammetry with Linear Scan, dnes je nazývána jako EVP - Elimination Voltammetric procedure, neboť se zjistilo, že eliminační metoda může být použita nejen pro voltametrii s lineárně se měnícím napětím, ale i pro voltametrii s čtvercovými vlnami (square wave voltammetry). Námi vyvinutá metoda pracuje na principu rozdílné závislosti dílčích proudů (difúzní, kapacitní, kinetický) na rychlosti polarizace elektrody (scan rate). Celkové voltametrické proudy naměřené při několika rychlostech polarizace jsou matematicky zpracovány do tzv. eliminační funkce a jejím výsledkem je eliminační voltamogram, který umožňuje (i) zvýšit proudovou citlivost a stanovit zkoumaný analyt v nízkých koncentracích, tedy dostat se ke značně nižším detekčním limitům (ve spojení s akumulací látky na povrchu elektrody i k nanomolárním koncentracím), (ii) separovat překrývající se voltametrické signály, (iii) stanovit, zda elektroaktivní částice podléhá elektronovému přenosu v adsorbovaném stavu anebo zda tomuto přenosu předchází ještě chemická reakce. Teoretické základy EVP byly ověřeny experimentálně s dalším rozvojem metody bylo zjištěno, že v jednom typu eliminací (eliminace kapacitní a kinetické složky) EVP pro adsorbovanou elektroaktivní substanci poskytuje specifický signál ve tvaru píku-protipíku, který nepotřebuje opravu na linii základního elektrolytu (baseline correction).
Na pracovišti je intenzivně rozvíjena nová elektrochemická metoda – eliminační voltametrie. Jedná se o metodu, která je ve voltametrii schopna některé dílčí proudy eliminovat a jiné zachovávat a tím zvyšovat citlivost i selektivnost voltametrických technik. Dříve nesla naše metoda název EVLS jako Elimination Voltammetry with Linear Scan, dnes je nazývána jako EVP - Elimination Voltammetric procedure, neboť se zjistilo, že eliminační metoda může být použita nejen pro voltametrii s lineárně se měnícím napětím, ale i pro voltametrii s čtvercovými vlnami (square wave voltammetry). Námi vyvinutá metoda pracuje na principu rozdílné závislosti dílčích proudů (difúzní, kapacitní, kinetický) na rychlosti polarizace elektrody (scan rate). Celkové voltametrické proudy naměřené při několika rychlostech polarizace jsou matematicky zpracovány do tzv. eliminační funkce a jejím výsledkem je eliminační voltamogram, který umožňuje (i) zvýšit proudovou citlivost a stanovit zkoumaný analyt v nízkých koncentracích, tedy dostat se ke značně nižším detekčním limitům (ve spojení s akumulací látky na povrchu elektrody i k nanomolárním koncentracím), (ii) separovat překrývající se voltametrické signály, (iii) stanovit, zda elektroaktivní částice podléhá elektronovému přenosu v adsorbovaném stavu anebo zda tomuto přenosu předchází ještě chemická reakce. Teoretické základy EVP byly ověřeny experimentálně s dalším rozvojem metody bylo zjištěno, že v jednom typu eliminací (eliminace kapacitní a kinetické složky) EVP pro adsorbovanou elektroaktivní substanci poskytuje specifický signál ve tvaru píku-protipíku, který nepotřebuje opravu na linii základního elektrolytu (baseline correction).
"Pentelka" není jen obyčejná tužka a CD není jen nosičem dat - vývoj a charakterizace levného elektrochemického senzoru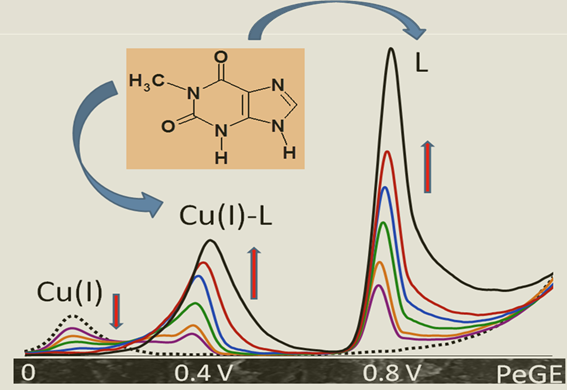 Rtuťové elektrody nejsou příliš vhodné pro miniaturizaci a automatizaci elektrochemických měření nukleových kyselin. Významnou přednost v těchto oblastech mají elektrody pevné, především založené na uhlíku a uhlíkových mikro a nanočásticích. Jednou z uhlíkových elektrod je i tuha do známých pentelkových tužek. Pentelkovou tužku lze využít jako nosiče tuh a díky některým typům s kovovými vodivými částmi lze získat reprodukovatelné elektrochemické signály v oblasti negativních i pozitivních potenciálů. Pentelkovou grafitovou elektrodu (Pencil graphite electrode - PeGE) využíváme pro stanovení purinových derivátů, jejichž oxidační signály se dají amplifikovat pomocí jednomocné mědi jako ligandu pro Cu(I)-purin komplex. Jednomocnou měď získáme in situ pomocí redukce Cu(II) na PeGE. Je velmi zajímavé se věnovat výzkumu povrchů jednotlivých PeGE, jejich modifikacím, které signifikantně ovlivňují elektrochemické signály purinů. Naše pozornost je zaměřena i na výzkum struktury komplexu Cu(I)-purin.
Rtuťové elektrody nejsou příliš vhodné pro miniaturizaci a automatizaci elektrochemických měření nukleových kyselin. Významnou přednost v těchto oblastech mají elektrody pevné, především založené na uhlíku a uhlíkových mikro a nanočásticích. Jednou z uhlíkových elektrod je i tuha do známých pentelkových tužek. Pentelkovou tužku lze využít jako nosiče tuh a díky některým typům s kovovými vodivými částmi lze získat reprodukovatelné elektrochemické signály v oblasti negativních i pozitivních potenciálů. Pentelkovou grafitovou elektrodu (Pencil graphite electrode - PeGE) využíváme pro stanovení purinových derivátů, jejichž oxidační signály se dají amplifikovat pomocí jednomocné mědi jako ligandu pro Cu(I)-purin komplex. Jednomocnou měď získáme in situ pomocí redukce Cu(II) na PeGE. Je velmi zajímavé se věnovat výzkumu povrchů jednotlivých PeGE, jejich modifikacím, které signifikantně ovlivňují elektrochemické signály purinů. Naše pozornost je zaměřena i na výzkum struktury komplexu Cu(I)-purin.
Další velmi levnou alternativou elektrod je zlatá elektroda vyrobená z CD nosiče - Gold CD trode - GCDT. Celková příprava není složitá, ale je třeba zlatý povrch CD oprostit od polymeru, pomocí galvanoplastické pásky a děrovacích kleští zajistit stejný povrch ponořené části CD elektrody a pomocí měděné pásky zaručit vodivý kontakt. Taková elektroda byla použita pro studium interakce aptameru (oligonukleotidu, který je schopen vázat určitý protein) a thrombinu. Elektrochemické signály ferro-ferri systému byly zaznamenány pomocí cyklické voltametrie a změny povrchu GCDT byly sledovány pomocí impedanční spektroskopie s skenovacího elektronového mikroskopu (SEM).
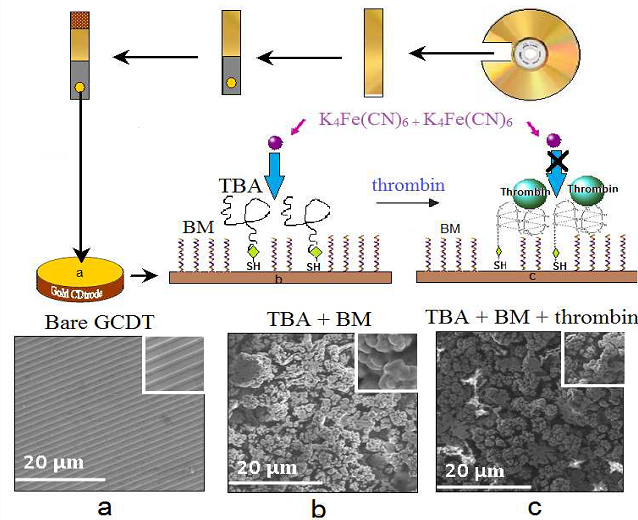
Schematická ilustrace konstrukce elektrody GCDT a jednotlivé kroky změny jejího povrchu testovaného pomocí redox-páru [Fe(CN)6]3+/4+: a) holá GCDT, b) thrombin aptamer (TBA) na GCDT- samouspořádaná vrstva, c) TBA-BM (B-merkaptoethanol) modifikace s přídavkem thrombinu. Povrch GCDT byl snímán pomocí skenovacího elektronového mikroskopu (SEM).
